QUIMICA
Química 1
DISCIPLINAS AUXILIARES DE LA QUIMICA
5. Relación de la química con otras ciencias
La química se relaciona con diferentes ciencias, por eso se dice que es multidisciplinaria, como la física, las matemáticas, la bioquímica, la astronomía, la biología, entre otras. Gracias a esta interrelación es posible explicar y comprender los complejos fenómenos de la naturaleza .Ejemplo: Física: Se estudia conjuntamente con la química en la ciencia fisicoquímica debido a que muchos fenómenos ocurren simultáneamente combinando las propiedades físicas con las químicas. Arqueología: Para descifrar datos e interrogantes como la antigüedad de piezas arqueológicas. La exactitud se logra por medio de métodos químicos como el del carbono 14.Biología: La ciencia de la vida, se auxilia de la química para determinar la composición estructura de tejidos y células. Astronomía: Se auxilia de la química para construcción de dispositivos, basados en compuestos químicos para lograr detectar algunos fenómenos del espacio exterior. Medicina: Como auxiliar de la biología y la química, esta ciencia se ha desarrollado grandemente ya que con esta se logra el control de ciertos desequilibrios de los organismos de los seres vivos
La Química trata esencialmente de la composición y el comportamiento de la naturaleza y se encuentra íntimamente relacionada con otras ciencias como la Física, el cual es una ciencia que también estudia la materia y la energía así como los cambios físicos que ocurren en naturaleza. La Biología es una ciencia que estudia a los seres vivos. En 1900 se establece la Bioquímica, al unirse ciertas áreas de Química y la Biología, áreas como Química de los microorganismos. Con las Matemáticas se relaciona por la necesidad de la representación numérica de los fenómenos que acontecen en la naturaleza realizados también por medio de estadísticas. La Historia proporciona acontecimientos y fechas sobre descubrimientos que son importantes para el trabajo de la Química.
La Geografía es una ciencia que se relaciona con la Química ubicando en forma exacta los lugares donde se encuentran los yacimientos de algunas substancias. Con la Ingeniería, se relaciona debido a la necesidad de construir instalaciones industriales que permitan la producción masiva de ciertas substancias y con la economía debido al interés de crear métodos para producir sustancias a precios competitivos con otros procesos. Con la Ecología, se relaciona debido a la necesidad de proteger el medio ambiente, particularmente conectado con los actuales problemas de contaminación. Con la Agricultura se relaciona debido al empleo de fertilizantes que permiten obtener cosechas con mayores rendimientos por hectárea cultivada.
La Química trata esencialmente de la composición y el comportamiento de la naturaleza y se encuentra íntimamente relacionada con otras ciencias como la Física, el cual es una ciencia que también estudia la materia y la energía así como los cambios físicos que ocurren en naturaleza. La Biología es una ciencia que estudia a los seres vivos. En 1900 se establece la Bioquímica, al unirse ciertas áreas de Química y la Biología, áreas como Química de los microorganismos. Con las Matemáticas se relaciona por la necesidad de la representación numérica de los fenómenos que acontecen en la naturaleza realizado también por medio de estadísticas. La Historia proporciona acontecimientos y fechas sobre descubrimientos que son importantes para el trabajo de la Química.
La Geografía es una ciencia que se relaciona con la Química ubicando en forma exacta los lugares donde se encuentran los yacimientos de algunas substancias. Con la Ingeniería, se relaciona debido a la necesidad de construir instalaciones industriales que permitan la producción masiva de ciertas substancias y con la economía debido al interés de crear métodos para producir sustancias a precios competitivos con otros procesos.
Con la Ecología, se relaciona debido a la necesidad de proteger el medio ambiente, particularmente conectado con los actuales problemas de contaminación. Con la Agricultura se relaciona debido al empleo de fertilizantes que permiten obtener cosechas con mayores rendimientos por hectárea cultivada.
Los cuerpos y la materia
6. Estados físicos de la materia
Estados químicos
ESTADOS DE LA MATERIA
La materia que nos rodea se presenta en tres estados físicos: sólido, líquido y gaseoso.
Cada estado tiene unas características propias que son:
|
Propiedades |
SÓLIDO |
LÍQUIDO |
GASEOSO |
|
Forma |
Mantienen su forma, por lo que no se adaptan a la forma del recipiente que los contiene |
No tienen forma propia. Se adaptan a la del recipiente |
No tienen forma propia. Se adaptan a la del recipiente |
|
Volumen |
Tienen un volumen fijo |
Tienen un volumen fijo |
No tienen volumen fijo. Se adaptan al del recipiente |
|
Compresibilidad |
No se comprimen |
No se comprimen |
Se comprimen |
|
Expansibilidad |
No se expanden |
No se expanden |
Se expanden |
|
Pueden fluir |
No fluyen |
Fluyen |
Fluyen |
7. Sustancias y mezclas
Sustancias puras
Una sustancia pura es cualquier material que tiene unas propiedades características que la distinguen claramente de otras.
Algunas de estas propiedades son difíciles de medir como el color, el olor o el sabor. Pero otras como la densidad o las temperaturas de fusión y ebullición se pueden determinar con exactitud en unas condiciones dadas.
Por ejemplo, el agua pura es transparente, sin olor ni sabor. Su densidad es de 1 g/ml a la temperatura de 15 ºC, sus temperatura de fusión y ebullición son 0 ºC y 100 ºC respectivamente (todo ello a la presión de una atmósfera).
Mezclas
Una mezcla está formada por la unión de varias sustancias puras que conservan propiedades independientes.
Si los componentes de la mezcla se distinguen a simple vista se dice que mezcla es heterogénea. En este tipo de mezcla sus componentes se pueden separar de forma sencilla (cribas, filtros, decantación, lixiviación...).
Si los componentes de la mezcla no se distinguen a simple vista, la mezcla es homogénea.
Este tipo de mezcla también se llama disolución. Podemos distinguirla de una sustancia pura porque los componentes tienen diferentes temperaturas de fusión o ebullición.
Coloides
En química un coloide, sistema coloidal, suspensión coloidal o dispersión coloidal es un sistema formado por dos o más fases, principalmente: una continua, normalmente fluida, y otra dispersa en forma de partículas; por lo general sólidas.1 La fase dispersa es la que se halla en menor proporción. Normalmente la fase continua es un líquido, pero pueden encontrarse coloides cuyos componentes se encuentran en otros estados de agregación.
El nombre de coloide proviene de la raíz griega kolas que significa «que puede pegarse». Este nombre que hace referencia a una de las principales propiedades de los coloides: su tendencia espontánea a agregar o formar coágulos.
Los coloides también afectan el punto de ebullición del agua y son contaminantes.
|
|
Fase dispersa |
|||
|
Fase continua |
No es posible porque todos los gases son solubles entre sí. |
Aerosol líquido, Ejemplos: niebla, bruma |
Aerosol sólido, Ejemplos: humo, polvo en suspensión |
|
|
Ejemplos: espuma de afeitado, nata |
Sol, Ejemplos: pinturas, tinta china |
|||
|
Ejemplos: piedra pómez, aerogeles, merengue. |
Gel, |
Ejemplos: cristal de rubí |
||
Cristaloide
Un cristaloide es un tipo de disolución con una estructura y propiedades diferentes de los coloides. Se emplean en terapia intravenosa para reponer líquidos perdidos. Están compuestas por solutos iónicos y no iónicos de baja masa molecular.1 Asimismo, un cristaloide es un sólido que tiene la apariencia de un cristal.
Las disoluciones cristaloides fueron estudiadas hacia 1850 por Thomas Graham, quien fue el primero en diferenciarlos de los coloides.
Los cristaloides de los líquidos orgánicos son la glucosa, la urea, la creatinina, los aminoácidos, las enzimas y las hormonas.
Un cristaloide es un líquido que suministra agua e iones sodio para mantener el gradiente de presión osmótica entre los compartimentos extravascular e intravascular.3 Contienen solutos en concentración igual o superior a la sangre por lo que son capaces de aumentar la presión osmótica. No contienen proteínas u otros coloides (moléculas de gran tamaño) por lo que disminuyen ligeramente la presión oncótica (o coloidoosmótica) al disminuir su concentración (hemodilución), por aumento del volumen total.
8. Ley periódica
La ley periódica es la base de la tabla periódica de los elementos. Esta ley señala que las propiedades químicas y físicas de los elementos tienden a repetirse de manera sistemática a medida que se incrementa el número atómico. La tabla, por lo tanto, es una especie de esquema que se encarga de ordenar los elementos químicos de acuerdo al orden creciente de los números atómicos.
La tabla periódica se organiza en filas horizontales, que se llaman periodos, y columnas verticales que reciben el nombre de grupos, además, por facilidad de representación, aparecen dos filas horizontales fuera de la tabla que corresponden a elementos que deberían ir en el sexto y séptimo periodo, tras el tercer elemento del periodo. Los grupos con mayor número de elementos, los grupos 1, 2, 13, 14, 15, 16, 17 y 18, se conocen como grupos principales, los grupos del 3 al 12 están formados por los llamados elementos de transición y los elementos que aparecen aparte se conocen como elementos de transición interna. Los elementos de la primera fila de elementos de transición interna se denominan lantánidos o tierras raras, mientras que los de la segunda fila son actínidos.
|
los grupos con mayor número de elementos, los grupos 1, 2, 13, 14, 15, 16, 17 y 18, se conocen como grupos principales, los grupos del 3 al 12 están formados por los llamados elementos de transición y los elementos que aparecen aparte se conocen como elementos de transición interna. Los elementos de la primera fila de elementos de transición interna se denominan lantánidos o tierras raras, mientras que los de la segunda fila son actínidos. |
|
Salvo el tecnecio y el prometio, todos los elementos de la tabla periódica hasta el uranio, se encuentran en la naturaleza. Los elementos transuránidos, así como el tecnecio y el prometio, son elementos artificiales, que no se hallan en la naturaleza, y han sido obtenidos por el hombre.
|
|
|
|
|
||
|
Los primeros dos grupos están completando orbitales s, el correspondiente a la capa que indica el periodo. Así, el rubidio, en el quinto periodo, tendrá es su capa de valencia la configuración 5s1, mientras que el bario, en el periodo sexto, tendrá la configuración 6s2. Los grupos 3 a 12 completan los orbitales d de la capa anterior a la capa de valencia, de forma que hierro y cobalto, en el periodo cuarto, tendrán las configuraciones 3d64s2 y 3d74s2, en la que la capa de valencia no se modifica pero sí la capa anterior. |
|
|||
Los grupos 13 a 18 completan los orbitales p de la capa de valencia. Finalmente, en los elementos de transición interna, los elementos completan los orbitales f de su antepenúltima capa. Así podemos saber, que para un periodo N, la configuración de un elemento será:
|
Grupos 1 y 2 |
Elemento de transición |
Grupos 13 a 18 |
Elementos de transición interna |
|
Nsx |
(N -1)dx Ns2 |
(N -1)d10 Ns2px |
(N -2)fx (N -1)d0 Ns2 |
9. Disposición de la tabla periódica
Metales alcalinos.- Corresponden a la familia IA de la Tabla Periódica, con excepción del hidrógeno que no es un metal. Presentan mayor carácter metálico que se incrementa con su número atómico. Son blandos, brillantes y reactivos, no se encuentra en estado elemental, solo combinados. Reaccionan violentamente con el agua y se conservan en aceite mineral o gasóleo.
Metales alcalinotérreos.- Están en el grupo IIA. Son menos reactivos que los alcalinos. Son de baja densidad, coloreados y blandos. Su flama presenta una coloración característica, que permite identificarlos por análisis cualitativo.
Metales térreos.- Son reactivos, no se encuentran en estado libre, sino formando generalmente óxidos o hidróxidos. El boro se diferencia porque es un semimetal. El aluminio es el más abundante en la tierra, es ligero. Junto con el Mg forman el duraluminio que se usa en la Aeronáutica
Metales de transición.- Se ubican en la zona central de la Tabla Periódica. Sus iones y compuestos suelen ser coloreados. Algunos elementos representativos de este grupo son el hierro, cobalto, níquel, mercurio, cobre, entre otros.
Halógenos.-Elementos del grupo VII A. Tienen mayor carácter no metálico. Forman compuestos con la mayoría de los elementos. Su carácter no metálico disminuye al aumentar el número atómico. De este grupo, el flúor y el cloro son gases, el bromo es el único no metal líquido y el yodo es sólido.
Gases nobles.- Se encuentran el el grupo VIII A. Son gases monoatómicos, incoloros, poco reactivos y rara vez se combinan con otros elementos.
El kriptón y xenón reaccionan con el oxígeno y el flúor para formar algunos compuestos

10. Predicción de fórmulas mediante el uso de la tabla periódica
Uso de la tabla periódica para determinar nombres y fórmulas
A partir de las reglas de nomenclatura estudiadas y con los conocimientos de la tabla periódica y estructura atómica, se debe poder deducir correctamente nombres y fórmulas de otras sustancias menos comunes.
Ejemplo: determinar el nombre de la fórmula KMnO4
Respuesta:
Primero: analizamos la fórmula escribiendo los números de oxidación

Segundo: buscamos en la tabla periódica los números de oxidación del manganeso

Tercero: comparamos el manganeso con el cloro porque tiene más de dos números de oxidación.

Así pues, el número de masa se refiere a la suma de protones y neutrones presentes en el núcleo de un átomo; este valor está representado por la letraA, la que siempre está ubicada en la parte superior izquierda del símbolo químico, a manera de exponente.
Los tres símbolos juntos, el del elemento químico, el del número de masa y el del número atómico, forman lo que se conoce como "notación isotópica", así:

Además, si se resta el número de masa del número atómico luego se obtiene la cantidad de neutrones de un átomo. Por ejemplo:

La operación anterior siempre va a obedecer a la formula siguiente, que relaciona al número atómico con el número de masa:

Los átomos de un mismo elemento tienen el mismo número atómico, pero pueden tener diferente número de masa, esto último debido a la presencia de isótopos*, los que tienen igual cantidad de protones, pero distinta cantidad de neutrones.
Masa atómica.
También es conocida como peso atómico. Los protones, neutrones y electrones son materia, por lo tanto tienen masa o peso; pero, los neutrones y protones tienen mayor cantidad de masa que los electrones, por estar juntos en el núcleo; además, los electrones son muy pequeños y están fuera del núcleo, por lo que su masa se desprecia. Por esto último, la masa atómica se define entonces como el peso de la masa del núcleo (el peso de la masa de los neutrones más el peso de la masa de los protones); sin embargo, muchos elementos tienen isótopos, por lo que la masa atómica de estos elementos seria “el peso promedio de las masas de los núcleos de los isótopos", en comparación con la masa atómica del Carbono 12.
Por lo general la masa atómica se expresa en uma, que significa unidad de masa atómica; no se debe confundir el número de masa con la masa atómica, pues son términos diferentes.
Estructura electrónica.
Esta propiedad nos enseña que todos los electrones de un átomo están distribuidos en niveles de energía, luego en subniveles y, finalmente, en orbitales. Esto nos indica que cada electrón ocupa un lugar único y bien definido dentro de un átomo, y los cuatro números quánticos definen muy bien dicho lugar.
*Isótopos: son átomos de un mismo elemento químico, y que tienen la misma cantidad de protones pero diferente cantidad de neutrones.
Valencia
Se le llama también número de combinación. La valencia es la cantidad de enlaces, combinaciones o uniones que un átomo forma con otros átomos; un átomo se une a otro átomo por medio de los electrones que están en el último nivel de energía, por lo que a estos electrones se les denominan "electrones de valencia". Así, un átomo puede unirse a uno, dos, tres y más átomos, formándose así una cierta cantidad de enlaces o combinaciones, lo que es igual a su valencia o capacidad de unión; los átomos de varios elementos químicos pueden tener más de una valencia, por ejemplo, los átomos de Hierro pueden formar en ciertas ocasiones 2 enlaces o combinaciones con otros átomos, y en otros casos estos átomos formaran tres enlaces. Por lo tanto, el Hierro presenta dos valencias: 2 y 3.
Ampliación de nuestros conocimientos sobre la estructura de la materia
11.-Teoria Atómica De Dalton
11.-TEORÍA ATÓMICA DE DALTON
|
Fue el primer modelo atómico con bases científicas, fue formulado en 1808 por John Dalton, quien imaginaba a los átomos como diminutas esferas. Este primer modelo atómico postulaba: |
|
1 - Toda la materia es discreta y está formada por partículas pequeñas, definidas e indestructibles denominadas átomos, que son indivisibles por los métodos químicos ordinarios. |
|
2 - Los átomos de un mismo elemento son iguales y tienen las mismas propiedades; los átomos de elementos distintos son diferentes y tienen propiedades también diferentes |
|
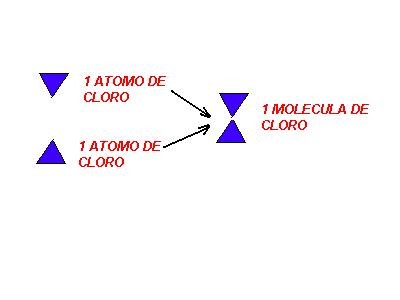
3 - Las moléculas se forman por la unión de un número entero de átomos del mismo o de distintos elementos, en relaciones numéricas simples. (1:1; 2:1; 3:2; etc. ) En el siguiente ejemplo se representa la formación de una molécula de cloro Cl2, a partir de dos átomos de cloro: relación numérica 1:1
|
|
4 - Las sustancias simples y compuestas están constituidas por moléculas.
|
|
5 - Las moléculas de una misma sustancia son iguales en todos sus aspectos y distintas a las de otras sustancias,
|
12.- composición de las sustancias
Introduce la idea de la discontinuidad de la materia, es decir, ésta es la primera teoría científica que considera que la materia está dividida en átomos.
Sin embargo desapareció ante el modelo de Thomson ya que no explica los rayos catódicos, la radioactividad ni la presencia de los electrones (e-) o protones(p+).
. Modelo atómico de Thomson.

Luego del descubrimiento del electrón en 1897 por Joseph John Thomson, se determinó que la materia se componía de dos partes, una negativa y una positiva. La parte negativa estaba constituida por electrones, los cuales se encontraban según este modelo inmersos en una masa de carga positiva a manera de pasas en un pastel (de la analogía del inglés plum-pudding model) o uvas en gelatina. Posteriormente Jean Perrin propuso un modelo modificado a partir del de Thomson donde las «pasas» (electrones) se situaban en la parte exterior del «pastel» (la carga positiva).
Para explicar la formación de iones, positivos y negativos, y la presencia de los electrones dentro de la estructura atómica, Thomson ideó un átomo parecido a un pastel de frutas. Una nube positiva que contenía las pequeñas partículas negativas (los electrones) suspendidos en ella. El número de cargas negativas era el adecuado para neutralizar la carga positiva. En el caso de que el átomo perdiera un electrón, la estructura quedaría positiva; y si ganaba, la carga final sería negativa. De esta forma, explicaba la formación de iones; pero dejó sin explicación la existencia de las otras radiaciones.
Modelo de Rutherford

Modelo atómico de Rutherford.
Este modelo fue desarrollado por el físico Ernest Rutherford a partir de los resultados obtenidos en lo que hoy se conoce como el experimento de Rutherford en 1911. Representa un avance sobre el modelo de Thomson, ya que mantiene que el átomo se compone de una parte positiva y una negativa, sin embargo, a diferencia del anterior, postula que la parte positiva se concentra en un núcleo, el cual también contiene virtualmente toda la masa del átomo, mientras que los electrones se ubican en una corteza orbitando al núcleo en órbitas circulares o elípticas con un espacio vacío entre ellos. A pesar de ser un modelo obsoleto, es la percepción más común del átomo del público no científico.
Rutherford predijo la existencia del neutrón en el año 1920, por esa razón en el modelo anterior (Thomson), no se habla de éste.
Por desgracia, el modelo atómico de Rutherford presentaba varias incongruencias:
Contradecía las leyes del electromagnetismo de James Clerk Maxwell, las cuales estaban muy comprobadas mediante datos experimentales. Según las leyes de Maxwell, una carga eléctrica en movimiento (en este caso el electrón) debería emitir energía constantemente en forma de radiación y llegaría un momento en que el electrón caería sobre el núcleo y la materia se destruiría. Todo ocurriría muy brevemente.No explicaba los espectros atómicos.
Modelo de Bohr
Este modelo es estrictamente un modelo del átomo de hidrógeno tomando como punto de partida el modelo de Rutherford, Niels Bohr trata de incorporar los fenómenos de absorción y emisión de los gases, así como la nueva teoría de la cuantización de la energía desarrollada por Max Planck y el fenómeno del efecto fotoeléctrico observado por Albert Einstein.
«El átomo es un pequeño sistema solar con un núcleo en el centro y electrones moviéndose alrededor del núcleo en órbitas bien definidas». Las órbitas están cuantizadas (los e- pueden estar solo en ciertas órbitas)
Cada órbita tiene una energía asociada. La más externa es la de mayor energía.
Los electrones no radian energía (luz) mientras permanezcan en órbitas estables.
Los electrones pueden saltar de una a otra órbita. Si lo hace desde una de menor energía a una de mayor energía absorbe un cuanto de energía (una cantidad) igual a la diferencia de energía asociada a cada órbita. Si pasa de una de mayor a una de menor, pierde energía en forma de radiación (luz).
El mayor éxito de Bohr fue dar la explicación al espectro de emisión del hidrógeno. Pero solo la luz de este elemento. Proporciona una base para el carácter cuántico de la luz, el fotón es emitido cuando un electrón cae de una órbita a otra, siendo un pulso de energía radiada.
Bohr no pudo explicar la existencia de órbitas estables y para la condición de cuantización.
Bohr encontró que el momento angular del electrón es h/2π por un método que no puede justificar.
13.- naturaleza de la carga eléctrica
Los protones (partículas que forman parte del núcleo del átomo) y electrones (que rodean el núcleo del átomo) crean fuerzas de atracción y de repulsión debido a que estas partículas atómicas tienen una carga eléctrica.
Se puede establecer una ley muy sencilla en relación a las fuerzas de atracción y repulsión entre partículas: las cargas de diferente símbolo se atraen y las del mismo signo se repelen.
1. La carga de un protón es la misma que la de un electrón, con la diferencia de que la carga de protones es positiva y la de los electrones negativa.
2. En cambio, los neutrones no tienen carga eléctrica, ni positiva ni negativa. Por lo tanto los neutrones no son atraídos ni repelidos por los protones ni los electrones.
La carga eléctrica es una propiedad general de la materia que se puede medir, cuya unidad es el Coulomb (C).
La masa y la carga eléctrica de las principales partículas subatómicas son:
|
|
Masa (Kg) |
Carga (C) |
|
Protón (p) |
1,6725 • 10-27 |
1,6 • 10 -19 |
|
Neutrón (n) |
1,6748 • 10-27 |
- |
|
Electrón (e) |
9,1095 • 10-31 |
1,6 • 10 -19 |
3. El campo eléctrico
El campo eléctrico es el espacio alredededor de una carga eléctrica. En él se manifiestan las fuerzas de atracción o de repulsión sobre otras cargas eléctricas situadas en este espacio.
4. Pérdida o ganancia de electrones
En relación a la naturaleza eléctrica del átomo, hay que destacar que la carga eléctrica de un átomo es nula porque al tener el mismo número de protones que de electrones, teniendo así la misma cantidad de cargas positivas que negativas.
Hay, sin embargo, excepciones que hay que tener en cuenta:
En algunas situaciones los átomos pueden perder o ganar electrones y quedar cargados eléctricamente. Estos átomos se llaman iones.
Cuando un átomo pierde uno o diversos electrones queda cargado positivamente y recibe el nombre de catión.
De forma contraria, cuando un átomo gana uno o varios electrones queda cargado negativamente, recibiendo el nombre de anión.
14.- Descubrimiento De Los Iones
Historia del descubrimiento
Un ion ("yendo", en griego; [ion] es el participio presente del verbo ienai: ‘ir’) Este término fue introducido por el físico Inglés y químico Michael Faraday en 1834 para la especie entonces-desconocidos que va desde un electrodo al otro a través de un medio acuoso. Faraday no conocía la naturaleza de estas especies, pero sabía que ya que los metales disueltos en solución y se introdujeron en un electrodo y nuevo metal salieron de la solución en el otro electrodo, que algún tipo de sustancia se movió a través de la solución en una corriente, transporte de materia de un lugar a otro.
Faraday también introdujo las palabras anión de un ion con carga negativa, y el catión de una cargada positivamente. En la nomenclatura de Faraday, cationes fueron nombrados porque fueron atraídos hacia el cátodo en un dispositivo galvánico y aniones fueron nombrados por su atracción hacia el ánodo.
.
Los iones cargados negativamente, producidos por haber más electrones que protones, se conocen como aniones (que son atraídos por el ánodo) y los cargados positivamente, consecuencia de una pérdida de electrones, se conocen como cationes (los que son atraídos por el cátodo).
Anión y catión significan:
- Anión ("el que va hacia abajo") tiene carga eléctrica negativa.
- Catión ("el que va hacia arriba") tiene carga eléctrica positiva.
Ánodo y cátodo utilizan el sufijo '-odo', del griego odos (-οδος), que significa camino o vía.
- Ánodo: ("camino ascendente de la corriente eléctrica") polo positivo".
- Cátodo: ("camino descendente de la corriente eléctrica") polo negativo".
Un ion conformado por un solo átomo se denomina ion monoatómico, a diferencia de uno conformado por dos o más átomos, que se denomina ion poliatómico.
15.- EL ATOMO NUCLEARIO
Se define el número atómico del elemento como la cantidad de protones que contiene el núcleo en uno de sus átomos.La masa atómica es el peso comparado de un núcleo atómico. Su unidad es la u.m.a (unidad de masa atómica) que se define como la doceava parte del peso del carbono –12. Un elemento es él y no otro por su número atómico. Así, el uranio lo es porque tiene 92 protones; si no fuera así dejaría de ser uranio. Sin embargo, un mismo elemento puede tener átomos de distinto número de neutrones. A los núcleos que tienen igual número de protones y distinto el de neutrones se les denominas isótopos. La existencia de isótopos de un mismo elemento es una razón por la que los pesos atómicos expresados en las tablas químicas no son números enteros.
Una anotación aceptada para indicar el número y la masa atómica de un núcleo es colocando la masa atómica en la parte superior izquierda del símbolo del elemento, y el número atómico en la inferior izquierda.
El número que indica la masa atómica se representa por A mayúscula y el que indica el número atómico se representa por una Z mayúscula.
Únicamente ciertas combinaciones de Z y A forman núcleos estables: si hay demasiados neutrones, o demasiados pocos, el núcleo sufrirá más pronto o más tarde un cambio, una desintegración radiactiva, que la llevará a la estabilidad en uno o varios pasos. El grado de es inestabilidad se pone de manifiesto por la energía emitida en la desintegración, así como en la velocidad de ésta. Tal velocidad de desintegración se mide por la vida media o período de semidesintegración, que es el tiempo necesario para que el número de átomos inicialmente presente se reduzca a la mitad por desintegración.
16.-Números atómicos de los elementos
En química, el número atómico es el número total de protones que tiene el átomo. Se suele representar con la letra Z (del alemán: Zahl, que quiere decir número) y es la identidad del átomo, y sus propiedades vienen dadas por el número de partículas que contiene. Los átomos de diferentes elementos tienen diferentes números de electrones y protones. Un átomo en su estado natural es neutro y tiene número igual de electrones y protones. Un átomo de sodio Na tiene un número atómico 11, posee 11 electrones y 11 protones. Un átomo de magnesio Mg, tiene número atómico 12, posee 12 electrones y 12 protones, y un átomo de uranio U, que tiene número atómico 92, posee 92 electrones y protones. Se coloca como subíndice a la izquierda del símbolo del elemento correspondiente. Por ejemplo, todos los átomos del elemento hidrógeno tienen 1 protón y su Z = 1; esto sería ₁H. Los de helio tienen 2 protones y Z =2; asimismo ₂He. Los de litio, 3 protones y Z = 3,…
Si el átomo es neutro, el número de electrones coincide con el de protones y nos lo da Z. En 1913 Henry Moseley demostró la regularidad existente entre los valores de las longitudes de onda de los rayos X emitidos por diferentes metales tras ser bombardeados con electrones, y los números atómicos de estos elementos metálicos. Este hecho permitió clasificar a los elementos en la tabla periódica en orden creciente de número atómico. En la tabla periódica los elementos se ordenan de acuerdo a sus números atómicos en orden creciente.
17.- isotopos de los elemento
Se llaman isótopos cada una de las variedades de un átomo de cierto elemento químico, los cuales varían en el núcleo atómico. El núcleo presenta el mismo número atómico (Z), constituyendo por lo tanto el mismo elemento, pero presenta distinto número másico (A).
Los diferentes átomos de un mismo elemento, a pesar de tener el mismo número de protones y electrones (+ y -), pueden diferenciarse en el número de neutrones. Puesto que el número atómico es equivalente al número de protones en el núcleo, y el número másico es la suma total de protones y neutrones en el núcleo, los isótopos del mismo elemento sólo difieren entre ellos en el número de neutrones que contienen.
Los elementos, tal como se encuentran en la naturaleza, son una mezcla de isótopos. La masa atómica que aparece en la tabla periódica es el promedio de todas las masas isotópicas naturales, de ahí que mayoritariamente no sean números enteros.
En la notación científica, los isótopos se identifican mediante el nombre del elemento químico seguido del número de nucleones (protones y neutrones) del isótopo en cuestión, por ejemplo hierro-57, uranio-238 y helio-3; en la notación simbólica, el número de nucleones se denota como superíndice prefijo del símbolo químico, en los casos anteriores: 57Fe, 238U y 3He.
Tipos
Isótopos Naturales. Los isótopos naturales son los que se encuentran en la naturaleza de manera natural, por ejemplo el hidrógeno tiene tres isótopos naturales, el protio que no tiene neutrones, el deuterio con un neutrón, y el tritio que contiene dos neutrones, el tritio es muy usado en trabajos de tipo nuclear; es el elemento esencial de la bomba de hidrógeno.
Otro elemento que contiene isótopos muy importantes es el carbono, que son: el carbono 12, que es la base referencial del peso atómico de cualquier elemento, el carbono 13 que es el único carbono con propiedades magnéticas y el carbono 14 radioactivo, muy importante ya que su tiempo de vida media es de 5730 años y se usa mucho en arqueología para determinar la edad de los fósiles orgánicos.
Isótopos Artificiales. Los isótopos artificiales se producen en laboratorios nucleares por bombardeo de partículas subatómicas; estos isótopos suelen tener una vida corta, principalmente por la inestabilidad y radioactividad que presentan; uno de estos es el Cesio cuyos isótopos artificiales se usan en plantas nucleares de generación eléctrica; otro muy usado es el Iridio 192 que se usa para comprobar la hermeticidad de las soldaduras de tubos, sobre todo en tubos de transporte de crudo pesado y combustibles. Algunos isótopos del Uranio también se usan para labores de tipo nuclear como generación eléctrica o en bombas atómicas basadas en la fisión nuclear.
Los isótopos se subdividen en isótopos estables (existen menos de 300) y no estables o isótopos radiactivos (existen alrededor de 1200). El concepto de estabilidad no es exacto, ya que existen isótopos casi estables. Su estabilidad se debe al hecho de que, aunque son radiactivos, tienen una semivida extremadamente larga comparada con la edad de la Tierra
18.- Masa Atómica
|
La masa atómica es el número resultante de la suma simple de la cantidad de unidades de protones y neutrones de un solo átomo (cuando el átomo no tiene movimiento). Si un átomo tiene un protón y un neutrón su Masa Atómica será de 2; si tiene un protón y dos neutrones entonces será de tres, y así sucesivamente. La masa atómica es algunas veces usada incorrectamente como un sinónimo de masa atómica relativa, masa atómica media y peso atómico; estos últimos difieren sutilmente de la masa atómica. La masa atómica está definida como la masa de un átomo, que sólo puede ser de un isótopo a la vez, y no es un promedio ponderado en las abundancias de los isótopos. En el caso de muchos elementos que tienen un isótopo dominante, la similitud/diferencia numérica real entre la masa atómica del isótopo más común y la masa atómica relativa o peso atómico estándar puede ser muy pequeña, tal que no afecta muchos cálculos bastos, pero tal error puede ser crítico cuando se consideran átomos individuales. Para elementos con más de un isótopo común, la diferencia puede llegar a ser de media unidad o más (por ejemplo, cloro). La masa atómica de un isótopo raro puede diferir de la masa atómica relativa o peso atómico estándar en varias unidades de masa. Su formulación es: A = Z + N A= Masa Atómica Z= Número atómico (Protones) N= Neutrones Ejemplo: Magnesio ----------> A----------->12 + N N------------->A-Z ------------>24 -12------------>12 Reemplazando A--------------->12 + 12--------------->24 |
19. Teoría Atómica Moderna
Las distintas teorías que han surgido desde Dalton, han llegado a una serie de postulados que se complementan entre sí, pero que poco a poco han ido evolucionados. La Teoría Atómica Moderna, es también conocida como Teoría Cuántica, la cual llega a ser desarrollada y completada de la siguiente manera. Las teorías de Bohr, así como los experimentos de Rutherford, además de Franks y Hertz, Goudsmit y Uhlenbeck, complementan a Planck, quien sea el primero en proponer una teoría cuántica. Mas adelante aparece Heisenberg, quien formula la mecánica de Matrices y la teoría de Incertidumbre; Broglie que crea la Mecánica Ondulatoria, además Schrödinger viene a comprobar que todas estas se unen en una sola, a la que se le llamó Mecánica Cuántica, que es la aplicación misma de la Teoría Cuántica. La Mecánica Cuántica la forman: Mecánica de matrices, Teoría de incertidumbre y Mecánica ondulatoria.
19.1- El modelo de Bohr
Es el actual modelo atómico, núcleo de un átomo ya estaba cargado de protones (+) y neutrones (-).
Este modelo es estrictamente un modelo del átomo de hidrógeno tomando como punto de partida el modelo de Rutherford, Niels Bohr trata de incorporar los fenómenos de absorción y emisión de los gases, así como la nueva teoría de la cuantización de la energía desarrollada por Max Planck y el fenómeno del efecto fotoeléctrico observado por Albert Einstein.
19.2.- Niveles de Energía de los Electrones

Una de las principales ideas de Bohr –que contribuyó al concepto moderno del átomo– fue que la energía del electrón está cuantizada, es decir, que el electrón está limitado sólo a ciertas energías permitidas.
El modelo mecánico-ondulatorio del átomo (Física cuántica) también predice niveles principales de energía. Estos niveles se designan con la letra n, donde n es un número entero positivo. De esta manera, n = 1 corresponde al nivel energético principal más bajo. A medida que n aumenta, también se incrementa la energía del electrón y, en promedio, el electrón se encuentra más alejado del núcleo.
En la tabla periódica se pueden encontrar, para los elementos en su estado fundamental, hasta siete niveles de energía o capas en las que pueden situarse los electrones. Cada nivel de energía se divide según el momento angular orbital que lo describe, al que se le asigna una letra determinada: s,p, d, f.
Para cada momento angular hay un número determinado de orbitales, según la proyección en una dirección dada del momento angular. Luego, en cada proyección pueden contener, como máximo, dos electrones cada uno diferenciados por el spin, un movimiento asociado clásicamente al giro sobre su eje.
La distribución de orbitales y número de electrones posibles en los cuatro primeros niveles se resume en la siguiente tabla:
|
Niveles de energía (n) |
1 |
2 |
3 |
4 |
|
Subniveles |
s |
s p |
s p d |
s p d f |
|
Número de orbitales de cada tipo |
1 |
1 3 |
1 3 5 |
1 3 5 7 |
|
Denominación de los orbitales |
1s |
2s 2p |
3s 3p 3d |
4s 4p 4d 4f |
|
Número máximo de electrones en los orbitales |
2 |
2 - 6 |
2 - 6 - 10 |
2 - 6 - 10 -14 |
|
Número máximo de electrones por nivel |
2 |
8 |
18 |
32 |
19.3. El Átomo de Hidrógeno
El átomo de hidrógeno es el átomo más simple que existe y el único que admite una solución analítica exacta desde el punto de vista de la mecánica cuántica.
También es como átomo monoelectrónico, debido a que está formado por un protón que se encuentra en el núcleo del átomo y que contiene más del 99% de la masa del átomo, y un sólo electrón que "orbita" alrededor de dicho núcleo (aunque también pueden existir átomos de hidrógeno con núcleos formados por un protón y 1 o 2 neutrones más, llamados deuterio y tritio).
Se puede hacer una analogía pedagógica del átomo de hidrógeno con un Sistema Solar, donde el sol sería el único Núcleo atómico y que tiene la mayor cantidad de masa 99% y en su órbita tuviera un planeta (Electrón) que conformaría el 1% restante de la masa del sistema solar (átomo de proteo (1H)), esto hace que el hidrógeno sea el más simple de todos los elementos de la tabla periódica de los elementos.
19.4. ESTRUCTURAS ELECTRÓNICAS DE LOS ELEMENTOS

19.5. DIAGRAMADO DE ESTRUCTURAS ATÓMICAS.

19.6. REPRESENTACIÓN PUNTUAL DE LEWIS PARA LOS ELECTRONES.
Esta representación se usa para saber la cantidad de electrones de valencia de un elemento que interactúan con otros o entre su misma especie, formando enlaces ya sea simples, dobles, o triples y estos se encuentran íntimamente en relación con los enlaces químicos entre las moléculas y su geometría molecular, y la distancia que hay entre cada enlace formado.
Las estructuras de Lewis muestran los diferentes átomos de una determinada molécula usando su símbolo químico y líneas que se trazan entre los átomos que se unen entre sí. En ocasiones, para representar cada enlace, se usan pares de puntos en vez de líneas. Los electrones desapartados (los que no participan en los enlaces) se representan mediante una línea o con un par de puntos, y se colocan alrededor de los átomos a los que pertenece
Este modelo fue propuesto por Gilbert N. Lewis quien lo introdujo por primera vez en 1916 en su artículo La molécula y el átomo.
19.7. REGLA DEL OCTETO.
La regla del octeto, establece que los átomos se enlazan unos a otros en el intento de completar su capa de valencia (última capa de la electrosfera). La denominación “regla del octeto” surgió en razón de la cantidad establecida de electrones para la estabilidad de un elemento, o sea, el átomo queda estable cuando presenta en su capa de valencia 8 electrones. Para alcanzar tal estabilidad sugerida por la regla del octeto, cada elemento precisa ganar o perder (compartir) electrones en los enlaces químicos, de esa forma ellos adquieren ocho electrones en la capa de valencia. Veamos que los átomos de oxígeno se enlazan para alcanzar la estabilidad sugerida por la regla del octeto. La justificativa para esta regla es que las moléculas o iones, tienden a ser más estables cuando la capa de electrones externa de cada uno de sus átomos está llena con ocho electrones (configuración de un gas noble). Es por ello que los elementos tienden siempre a formar enlaces en la búsqueda de tal estabilidad.
Los átomos son más estables cuando consiguen ocho electrones en la capa de su estado de óxido, sean pares solitarios o compartidos mediante enlaces covalentes. Considerando que cada enlace covalente simple aporta dos electrones a cada átomo de la unión, al dibujar un diagrama o estructura de Lewis, hay que evitar asignar más de ocho electrones a cada átomo.
19.8. ENERGÍA DE IONIZACIÓN Y AFINIDAD ELECTRÓNICA.
La energía de ionización se define como:
|
La energía que se debe aplicar a un átomo neutro en su estado fundamental para extraerle su electrón más débilmente ligado. Abreviadamente se denota como Ei |
Es un proceso endotérmico que se puede representar así:
X + Ei ----> X + E-
La energía de ionización se mide en electrón-voltios (eV) para el átomo aislado y en kJ )kilojulios)para un mol de átomos.
Por ejemplo para el átomo de hidrógeno son necesarios 1312.0 kJ/mol.
En una gráfica en la que se representa el número atómico versus la energía de ionización (kJ/mol) la Ei varia de una manera amplia, desde el valor bajo del cesio (375.5 kJ/mol) a un valor de 2372.3 kJ/mol para el helio. Se observa también una clara periodicidad en los datos. Los valores mínimos de
En la tabla periódica, la energía de ionización disminuye al bajar en un grupo porque en este sentido aumenta el número de capas electrónicas y con ello el apantallamiento del núcleo frente al electrón a extraer.
Al aumentar el número atómico dentro de un periodo, la energía de ionización aumenta porque aumenta el número de protones del núcleo sin que aumente el número de capas, con lo que el apantallamiento permanece prácticamente constante.
La ionización no está limitada a la extracción de un único electrón en un átomo. Dos o tres o más electrones pueden ser removidos secuencialmente de un átomo, y la cantidad de energía en cada etapa puede ser cuantificada.
X + E --------> X + e- Primera energía de ionización Ei1
X + E --------> X2 + e- Segunda energía de ionización Ei2
X² + E --------> X³ + e- Tercera energía de ionización Ei3
Y así sucesivamente
La segunda energía de ionización (Ei2 , que supone la extracción del segundo electrón, es superior a la primera porque el átomo se ha convertido previamente en un catión (con carga positiva) y su atracción por el electrón será mayor oponiendo mayor resistencia a su extracción. Esto es, es más difícil extraer un electrón de un ión cargado positivamente (e.g. X que de un átomo neutro (X).
El valor de la energía de ionización está fuertemente condicionado por el tipo de configuración electrónica que se destruye al arrancar el electrón. Por ejemplo la segunda energía de ionización Ei2 de los metales alcalinos es relativamente mayor que la de otros elementos porque supone la destrucción del octeto de la penúltima capa, el cual es especialmente estable. Por ello las diferencias de energía de ionización para sucesivas etapas de extracción electrónica varia enormemente de un elemento a otro. Por ejemplo la extracción del segundo electrón del ión sodio (Na) requiere diez veces más de energía que para remover el primero del átomo neutro de sodio (Na) (4562 versus 496 kJ/mol), pero la extracción del segundo electrón del magnesio requiere solo dos veces más de energía que el primero (1451 versus 738 kJ/mol).
AFINIDAD ELECTRÓNICA
La afinidad electrónica (Eae) es el cambio energético que ocurre cuando un átomo capta un electrón para convertirse en un anión. Es por ello el fenómeno opuesto a la ionización electrónica:
X + e- --------> X- + Eae
Es un proceso generalmente exotérmico. Así mientras que las energía de ionización son siempre positivas, debido a que una energía debe ser suministrada para extraer el electrón, las afinidades electrónicas son generalmente positivas debido a que la energía es liberada cuando a un átomo neutro se le añade un electrón.
Cuanto más negativa sea la energía Eae más grande es la tendencia de un átomo a aceptar un electrón y más estable será el anión que resulta. Por ejemplo, la Eae del hidrógeno es de -72.8 kJ/mol, lo que significa que dicha energía es liberada formándose un anión H- estable.
Como con la energía de ionización, las afinidades electrónicas muestran una periodicidad que está relacionada con la configuración de los elementos. El valor de la finida electrónica para un elemento es debido a la interrelación de varios factores contrapuestos. Así, la atracción entre los electrones adicionales y el núcleo favorecen valores de Eae más negativos, pero un incremento en las repulsión electrón-electrón que resulta de la adición de un electrón extra favorece valores positivos de Eae. Por ello, en la tabla periódica la afinidad electrónica disminuye conforme se desciende por el mismo por razón del mayor apantallamiento que proporcionan las capas electrónicas en número creciente. Por otra parte a lo largo de un periodo la afinidad electrónica aumenta debido al aumento de la carga del núcleo con igualdad del número de capas electrónicas.
La afinidades electrónicas las grandes (con mayor valor negativo) la tiene los halógenos (F, Cl, Br, I) debido a que cada uno de estos elementos tienen un alta Zeff y un hueco en su capa de valencia para admitir un nuevo electrón. Los aniones de estos elementos que se forman tienen una configuración de gas noble con los subniveles s y p rellenos y la atracción entre el electrón adicional y el núcleo atómico es alta. Por otra parte valores positivos de Ea se encuentra en los gases nobles (He, Ne, Ar, Kr, Xe) debido a que los subniveles en estos niveles están completos, y el electrón adicional debe ir a la capa de un nivel más alto, donde es apantallado del núcleo y experimenta una relativamente baja.
Por ello la atracción del núcleo en este caso al electrón añadido es por lo tanto pequeña y es sobrepasada por las repulsiones electrón-electrón adicionales.
Un halógeno ![]()
Un gas noble
19.9. ELECTRONES DE VALENCIA.
Los electrones de valencia son los electrones que se encuentran en los mayores niveles de energía del átomo, siendo estos los responsables de la interacción entre átomos de distintas especies o entre los átomos de una misma. Los electrones en los niveles de energía externos son aquellos que serán utilizados en la formación de compuestos y a los cuales se les denomina como electrones de valencia.
Estos electrones, conocidos como "electrones de valencia", son los que presentan la facilidad de formar enlaces. Estos enlaces pueden darse de diferente manera, ya sea por intercambio de estos electrones, por compartición de pares entre los átomos en cuestión o por el tipo de interacción que se presenta en el enlace metálico, que consiste en un "traslape" de bandas. Según sea el número de estos electrones, será el número de enlaces que puede formar cada átomo con otro u otros.
Sólo los electrones externos de un átomo pueden ser atraídos por otro átomo cercano. Por lo general, los electrones del interior son afectados en menor medida y tampoco los electrones en las subcapas d llenas y en las f, porque están en el interior del átomo y no en la superficie.
La valencia de un elemento es el número de electrones que necesita o que le sobra para tener completo su último nivel. La valencia de los gases nobles, por tanto, será cero, ya que tienen completo el último nivel. En el caso del sodio, la valencia es 1, ya que tiene un solo electrón de valencia, si pierde un electrón se queda con el último nivel completo.
.19.10. ENLACES QUÍMICOS.
Un enlace químico es el proceso químico responsable de las interacciones atractivas entre átomos y moléculas, y que confiere estabilidad a los compuestos químicos diatómicos y poliatómicos. La explicación de tales fuerzas atractivas es un área compleja que está descrita por las leyes de la química cuántica.
Sin embargo, en la práctica, los químicos suelen apoyarse en la fisicoquímica o en descripciones cualitativas que son menos rigurosas, pero más sencillas en su propia descripción del enlace químico (ver valencia). En general, el enlace químico fuerte está asociado con la compartición o transferencia de electrones entre los átomos participantes. Las moléculas, cristales, y gases diatómicos -o sea la mayor parte del ambiente físico que nos rodea está unido por enlaces químicos, que determinan las propiedades físicas y químicas de la materia.
Hay que tener en cuenta que las cargas opuestas se atraen, porque, al estar unidas, adquieren una situación más estable (de menor entalpía) que cuando estaban separados. Esta situación de mayor estabilidad suele darse cuando el número de electrones que poseen los átomos en su último nivel es igual a ocho, estructura que coincide con la de los gases nobles ya que loselectrones que orbitan el núcleo están cargados negativamente, y que los protones en el núcleo lo están positivamente, la configuración más estable del núcleo y los electrones es una en la que los electrones pasan la mayor parte del tiempo entre los núcleos, que en otro lugar del espacio. Estos electrones hacen que los núcleos se atraigan mutuamente
un enlace iónico o electrovalente es la unión de átomos que resulta de la presencia de atracción electrostática entre los iones de distinto signo, es decir, uno fuertemente electropositivo (baja energía de ionización) y otro fuertemente electronegativo (alta afinidad electrónica). Eso se da cuando en el enlace, uno de los átomos capta electrones del otro. La atracción electrostática entre los iones de carga opuesta causa que se unan y formen un compuesto químico simple.
Dado que los elementos implicados tienen elevadas diferencias de electronegatividad, este enlace suele darse entre un compuesto metálico y uno no metálico. Se produce una transferencia electrónica total de un átomo a otro formándose iones de diferente signo. El metal dona uno o más electronesformando iones con carga positiva o cationes con una configuración electrónica estable. Estos electrones luego ingresan en el no metal, originando un ion cargado negativamente o anión, que también tiene configuración electrónica estable. Son estables pues ambos, según la regla del octeto o por laestructura de Lewis adquieren 8 electrones en su capa más exterior (capa de valencia), aunque esto no es del todo cierto ya que contamos con varias excepciones, la del hidrógeno (H) que se llega al octeto con 2 electrones, el berilio (Be) con 4 ,el aluminio (Al) y el boro (B) que se rodean de seis.
Los compuestos iónicos forman redes cristalinas constituidas por iones de carga opuesta, unidos por fuerzas electrostáticas. Este tipo de atracción determina las propiedades observadas. Si la atracción electrostática es fuerte, se forman sólidos cristalinos de elevado punto de fusión e insolubles en agua.
19.11. EL ENLACE IÓNICO.
un enlace iónico o electrovalente es la unión de átomos que resulta de la presencia de atracción electrostática entre los iones de distinto signo, es decir, uno fuertemente electropositivo (baja energía de ionización) y otro fuertemente electronegativo (alta afinidad electrónica). Eso se da cuando en el enlace, uno de los átomos capta electrones del otro. La atracción electrostática entre los iones de carga opuesta causa que se unan y formen un compuesto químico simple.
Dado que los elementos implicados tienen elevadas diferencias de electronegatividad, este enlace suele darse entre un compuesto metálico y uno no metálico. Se produce una transferencia electrónica total de un átomo a otro formándose iones de diferente signo. El metal dona uno o más electronesformando iones con carga positiva o cationes con una configuración electrónica estable. Estos electrones luego ingresan en el no metal, originando un ion cargado negativamente o anión, que también tiene configuración electrónica estable. Son estables pues ambos, según la regla del octeto o por laestructura de Lewis adquieren 8 electrones en su capa más exterior (capa de valencia), aunque esto no es del todo cierto ya que contamos con varias excepciones, la del hidrógeno (H) que se llega al octeto con 2 electrones, el berilio (Be) con 4 ,el aluminio (Al) y el boro (B) que se rodean de seis.
Los compuestos iónicos forman redes cristalinas constituidas por iones de carga opuesta, unidos por fuerzas electrostáticas. Este tipo de atracción determina las propiedades observadas. Si la atracción electrostática es fuerte, se forman sólidos cristalinos de elevado punto de fusión e insolubles en agua.
19.12. EL ENLACE COVALENTE.
Un enlace covalente entre dos átomos o grupos de átomos se produce cuando estos, para alcanzar el octeto estable, comparten electrones del último nivel.1 La diferencia de electronegatividades entre los átomos no es suficiente.
De esta forma, los dos átomos comparten uno o más pares electrónicos en un nuevo tipo de orbital, denominado orbital molecular. Los enlaces covalentes se suelen producir entre elementos gaseosos o no metales.
El enlace covalente se presenta cuando dos átomos comparten electrones para estabilizar la unión.
A diferencia de lo que pasa en un enlace iónico, en donde se produce la transferencia de electrones de un átomo a otro; en el enlace covalente, los electrones de enlace son compartidos por ambos átomos. En el enlace covalente, los dos átomos no metálicos comparten uno o más electrones, es decir se unen a través de sus electrones en el último orbital, el cual depende del número atómico en cuestión. Entre los dos átomos pueden compartirse uno, dos o tres pares de electrones, lo cual dará lugar a la formación de un enlace simple, doble o triple respectivamente. En la representación de Lewis, estos enlaces pueden representarse por una pequeña línea entre los átomos
19.13.-IONES POLIATOMICOS


19.14.-EL ENLACE METÁLICO
El enlace metálico se produce cuando se combinan metales entre sí. Los átomos de los metales necesitan ceder electrones para alcanzar la configuración de un gas noble. En este caso, los metales pierden los electrones de valencia y se forma una nube de electrones entre los núcleos positivos.
19.15.-PROPIEDADES DE LOS COMPUESTOS IONICOS COVALENTES Y METALICOS
TIPOS DE ENLACE IONICO
Los átomos se unen entre sí para formar moléculas mediante fuerzas de enlace.
El enlace iónico consiste en la atracción electrostática entre átomos con cargas eléctricas de signo contrario. Este tipo de enlace se establece entre átomos de elementos poco electronegativos con los de elementos muy electronegativos. Es necesario que uno de los elementos pueda ganar electrones y el otro perderlo, y como se ha dicho anteriormente este tipo de enlace se suele producir entre un no metal (electronegativo) y un metal (electropositivo). Resultan normalmente de la reacción de un metal de bajo potencial de ionización con un no metal. Los electrones se transfieren del metal al no metal dando lugar a cationes y aniones. Las sustancias iónicas conducen la electricidad cuando están en estado líquido o en disoluciones acuosas, pero no en estado cristalino, porque los iones individuales son demasiado grandes para moverse libremente a través del cristal.
ENLACE COVALENTE
En este enlace cada uno de los átomos aporta un electrón. Los orbitales de las capas de valencia de ambos átomos se combinan para formar uno solo que contiene a los 2 electrones. Si los átomos enlazados son no metales e idéntico (como en N2 o en O2) los electrones son compartidos por igual por los dos átomos, y el enlace se llama covalente a polar. Si los átomos son compartidos son no metales pero distintos (como NO), los electrones en forma desigual y el enlace se llama covalente polar-polar por que la molécula tiene un polo eléctrico positivo y otro negativo y existe una diferencia de electronegatividad entre sus elementos, por lo tanto, existe diferente capacidad para atraer los electrones, y covalente por que los átomos comparten los electrones, aun quesea en forma desigual. Los compuestos que presentan este tipo de enlace suelen presentarse en estado líquido o gaseoso; su punto de fusión y ebullición no son muy elevados. Los sólidos macromoleculares, tienen altos puntos de fusión y ebullición son malos conductores y en general insolubles.
ENLACE METÁLICO
Suelen ser sólidos a temperatura ambiente; su punto de fusión y ebullición varían notablemente.Son enlaces entre átomos de elementos metálicos. Los elementos soncompartidos por los átomos, pero pueden moverse a través del sólido proporcionando conductividad térmica y eléctrica, brillo, maleabilidad y ductilidad .Mantienen unidos a los átomos de los metales entre sí, estos átomos se agrupan de forma muy cercana unos a otros.

19.16.-FUERZAS INTERMOLECULARES
Dentro de una molécula, los átomos están unidos mediante fuerzas intermoleculares (enlaces iónicos, metálicos o covalentes, principalmente). Estas son las fuerzas que se deben vencer para que se produzca un cambio químico. Son estas fuerzas, por tanto, las que determinan las propiedades químicas de las sustancias.
Sin embargo existen otras fuerzas intermoleculares que actúan sobre distintas moléculas o iones y que hacen que éstos se atraigan o se repelan. Estas fuerzas son las que determinan las propiedades físicas de las sustancias como, por ejemplo, el estado de agregación, el punto de fusión y de ebullición, la solubilidad, la tensión superficial, la densidad, etc.
Por lo general son fuerzas débiles pero, al ser muy numerosas, su contribución es importante. La figura inferior resume los diversos tipos de fuerzas intermoleculares. Pincha en los recuadros para saber más sobre ellas.

20.-NUMEROS DE OXIDACION
Los compuestos químicos son eléctricamente neutros, excepto los iones cuando los consideramos separadamente. Es decir, la carga que aporten todos los átomos de un compuesto tiene que ser globalmente nula, debemos tener en un compuesto tantas cargas positivas como negativas. Respecto a los iones, se dice que quedan con carga residual.
Para entender qué significa esto de que un compuesto sea eléctricamente neutro, veamos un ejemplo: tomemos el caso del ácido sulfúrico (H2SO4):
|
+1 |
+6 |
−2 |
|
|
H2 a |
S b |
O4 c |
|
|
a + |
b + |
c |
= 0 |
|
+2 |
+6 |
−8 |
= 0 |
El número que aparece sobre el símbolo del elemento debe colocarse como superíndice y con el signo más (+) o el menos (−) puesto a su izquierda, para diferenciarlo del número de carga de los iones en que el signo se pone a la derecha del digito. Así, H+1para indicar el número de oxidación del Hidrógeno (+1) y Ca2+ para indicar ión Calcio(2+).
Siguiendo la explicación de nuestro cuadro, los elementos se han identificado con las letras a, b y c para mostrar la ecuación que debe ser igual a cero.
Ahora bien, ese número de arriba representa algo que se llama número de oxidación o estado de oxidación y representa la carga eléctrica que aporta cada átomo en el compuesto y que sumadas debe ser igual a cero (eléctricamente neutro).
Pero, en nuestro ejemplo, + 1 + 6 − 2 es igual a +7 −2 = 5 (no es igual a cero como debería ser). Claro, pero debemos fijarnos en que son dos átomos de hidrógeno (H2), un átomo de azufre (S) y cuatro átomos de oxígeno (O4), así es que ese numerito de arriba se debe multiplicar por el número de átomos de cada elemento que participa en el compuesto, y nos quedará +2 +6 −8 = 0.
Conocer el número de oxidación de los elementos de un compuesto es de vital importancia para reconocer si una semirreacciónes de oxidación o de reducción en las reacciones de ese tipo
El número de oxidación es un número entero que representa el número de electrones que un átomo recibe (signo menos) o que pone a disposición de otros (signo más) cuando forma un compuesto determinado.
Eso significa que el número de oxidación es positivo si el átomo pierde electrones, o los comparte con un átomo que tenga tendencia a captarlos. Y será negativo cuando el átomo gane electrones, o los comparta con un átomo que tenga tendencia a cederlos.
El número de oxidación se escribe en números romanos: +I, +II, +III, +IV, -I, -II, -III, -IV, etc. Pero en esta explicación usamos caracteres arábigos para referirnos a ellos: +1, +2, +3, +4, -1, -2, -3, -4 etcétera, lo cual nos facilitará los cálculos al tratarlos como números enteros.
22.-COMPUESTOS BINARIOS
Los compuestos binarios están formados por dos elementos diferentes. Atendiéndose a su composición estos se clasifican en:
1. COMPUESTOS OXIGENADOS U ÓXIDOS.
Los óxidos están formados por oxígeno y otro elemento. Si el el elemento es un metal, se llaman óxidos metálicos, y óxidos no metálicos si el otro elemento es un no metal.
a. Oxidos metálicos, u óxidos básicos. (M + O2)
b. Tradicionalmente, cuando el metal tiene más de una valencia, para denominar a estos óxidos, se agrega al nombre del metal la terminación "oso" o "ico" según sea la valencia menor o mayor.
Otra forma designar estos óxidos consiste en indicar la valencia mediante un número romano: estos son los nombres de Stock ( químico alemán de este siglo).
EJEMPLOS:
Na2O óxido de sodio óxido de estaño
SnO óxido estanoso óxido de estaño (II)
SnO2 óxido estánico óxido de estaño (IV)
FeO óxido ferroso óxido de fierro (II)
Fe2O3 óxido férrico óxido de fierro (III)
Cu2O óxido cuproso óxido de cobre (I)
CuO óxido cúprico óxido de cobre (II)
c. Oxidos no metálicos. (NM + O2)
Para nombrar a estos óxidos se aplica la misma norma que rige para los óxidos metálicos. Un grupo importante de los óxidos no metálicos puede reaccionar con el agua para dar origen a los compuestos conocidos como oxiácidos, e estos óxidos se les denomina "anhídridos". En la nomenclatura tradicional se diferencian las valencias del no-metal mediante los sufijos "oso" e "ico" y los prefijos "hipo" y "per" según el siguiente esquema:
valencia
creciente
Para ver el grafico seleccione la opción "Descargar" del menú superior
EJEMPLOS:
Fórmula Nomenclatura tradicional Nomenclatura de Stock
SiO2 anhídrido silíco óxido de silicio
P2O3 anhídrido fosforoso óxido fósforo (III)
P2O5 anhídrido fosfórico óxido de fósforo (V)
Cl2O anhídrido hipocloroso óxido de cloro (I)
Cl2O3 anhídrido cloroso óxido de cloro (III)
Cl2O5 anhídrido clórico óxido de cloro (V)
Cl2O7 anhídrido perclórico óxido de cloro (VII)
1. COMPUESTOS BINARIOS HIDROGENADOS.
En este grupo se pueden distinguir dos subgrupos:
a.
b. Los hidruros. compuestos formados por hidrógeno y un metal. Se les nombra con la palabra
genérica "hidruro" seguida del nombre del metal.
EJEMPLO:
Fórmula Nombre
LiH hidruro de litio
NaH hidruro de sodio
AlH3 hidruro de aluminio
b. Los hidrido o hidrácidos. compuestos formados por hidrógeno y un no-metal.
EJEMPLO:
Fórmula Nombre
HCl cloruro de hidrógeno
ácido clorhídrico
HBr bromuro de hidrógeno
ácido bromhídrico
H2S sulfuro de hidrógeno
ácido sulhídrico
NH3 nitruro de hidrógeno
amoniaco
PH3 fosfuro de hidrógeno
fosfamina
1. SALES BINARIAS.
Estas sales son compuestos binarios que contienen un metal y un no-metal. Se les denomina utilizando el nombre del no-metal terminado en el sufijo "uro" y colocando a continuación el nombre del metal; mediante un número romano se indica el estado de oxidación del metal cuando éste presenta más de una valencia.
EJEMPLO:
Fórmula Nomenclatura tradicional Nomenclatura de Stock
KBr bromuro de potasio bromuro de potasio
FeCl2 cloruro ferroso cloruro de fierro (II)
FeCl3 cloruro férrico cloruro de fierro (III)
CuS sulfuro cúprico sulfuro de cobre (II)
EJEMPLOS
Algunos ejemplos:
Al2O3óxido de aluminio
Na2Oóxido de sodio
FeO óxido de fierro (II) u óxido ferroso
CrO3 óxido de cromo (VI) u óxido crómico
CuO óxido de cobre (II) u óxido cúprico
Hg2Oóxido de mercurio (I) u óxido mercuroso
Son OXIDOS ACIDOS cuando el segundo elemento es un NO METAL.
CO óxido de carbono (II) o monóxido de carbono
N2O3 óxido de nitrógeno (III) o trióxido de dinitrógeno
Cl2O3 óxido de cloro (III) o trióxido de dicloro
SO2 óxido de azufre (IV) o dióxido de azufre
P2O5 óxido de fósforo (V) o pentaóxido de difósforo
Br2O7 óxido de bromo (VII) o heptaóxido de dibromo
23.-COMPUESTOS TERNARIOS
Se llaman compuestos ternarios a aquellos que estan formados por tres elementos diferentes. Este conjunto de compuestos, igual que los binarios, incluye subtancias que pertenecen a funciones diferentes. Las más importantes son:
1. hidróxidos.
2. ácidos oxigenado u oxiácidos.
3. sales derivadas de los ácidos oxigenados.
1. FORMULACIÓN Y NOMENCLATUAR DE HIDRÓXIDOS.
Desde el punto de vista de su fórmula química, los hidróxidos pueden considerarse formados por un metal y el grupo monovalente OH (radical hidróxilo). Por lo tanto, la formulación de los hidróxidos sigue la misma pauta que la de los compuestos binarios.
EJEMPLO: Escribir la fórmula del hidróxido de aluminio.
a. se escribe el símbolo de Al y el grupo OH encerrado entre paréntesis: Al(OH)
b. se intercambian las valencias: Al1(OH)3
c. se suprime el subindice 1: Al(OH)3
Hidróxido de plomo (IV): Pb(OH)4
Hidróxido de sodio: NaOH
Hidróxido de cobalto (III): Co(OH)3
Hidróxido de germanio (IV): Ge(OH)4
La fórmula general de los hidróxidos es : M(OH)n , donde "n" indica el número de grupos OH unidos al metal.
Para nombrar los hidróxidos se utiliza la palabra "hidróxido" seguida del nombre del metal, indicando con número romano la valencia del metal, cuando es del caso.
EJEMPLO:
Fórmula Nomenclatura tradicional Nomenclatura de Stock
KOH hidróxido de potasio hidróxido de potasio
Al(OH)3hidróxido de aluminio hidróxido de aluminio
Fe(OH)2 hidróxido ferroso hidróxido de fierro (II)
Fe(OH)3 hidróxido férrico hidróxido de fierro (III)
1. FORMULACIÓN Y NOMENCLATURA DE ÁCIDOS OXIGENADOS U OXIÁCIDOS.
Los oxiácidos está constituidos por H, un no-metal y O. Para escribir las fórmulas de los oxiácidos, los símbolos de los átomos se anotan en el siguiente orden:
1º el símbolo de los átomos de hidrógeno.
2º el símbolo del elemento central, que da el nombre al oxiácido.
3º el símbolo del oxígeno.
Cada uno con su subíndice respectivo:
Ejemplo:
Ácido sulfúrico (H2SO4). Formado por la combinación de una molécula de H2O con una molécula de óxido sulfúrico SO3: SO3 + H2O → H2SO4
Ácido sulfuroso (H2SO3). Formado por la combinación de una molécula de H2O con una molécula de óxido sulfuroso SO2: SO2 + H2O → H2SO3
Ácido hiposulfuroso (H2SO2). Formado por la combinación de una molécula de H2O con una molécula de óxido hiposulfuroso SO: SO + H2O → H2SO2
24. INTRODUCCION A LA FORMACION DE LOS COMPUESTOS CUATERNARIOS
Los compuestos cuaternarios son aquellos que poseen un átomo de nitrógeno unido a cuatro sustituyentes alquílicos o arílicos. El nitrógeno en esta situación posee una carga positiva, que se mantiene independientemente del pH del medio. Esta característica es precisamente la que distingue los compuestos cuaternarios de los anfóteros y de las sales de amina.
Se dividen en tres subfamilias:
Sales de alquil bencil dimetil amonio
Sales de amonio heterocíclicas
Sales de tetraalquil amonio
Los compuestos cuaternarios son los formados por cuatro elementos.
Oxisales Ácidas: Son compuestos que resultan de la sustitución parcial de los hidrógenos, de ácidos oxácidos por un metal.
· Ejemplos:
· - Na HSO 4 = Sulfato ácido de Sodio.
· - KHCO3 = Carbonato ácido de Potasio.
· - Ca HSO 4 = Sulfato ácido de calcio.
· - Na HCO 3 = Carbonato ácido de sodio.
· - K 2 HSO 5 = Sulfato ácido de potasio.
· - Na 2 HPO 5 = Fosfato ácido de sodio.
Oxisales Dobles: Son compuestos que resultan de la sustitución total de los hidrógenos de los ácidos oxácidos de los grupos V y VI y el ácido carbónico.
· Ejemplos:
· - K Li SO 3 = Sulfato doble de litio y potasio.
· - Na Ba PO 4 = Fosfato doble de bario y sodio.
· - Na Li SO 3 = Sulfato doble de litio y sodio.
· - Cs Rb PO 5 = Fosfato doble de rubidio y cesio.
· - Ba Ca CO 3 = Carbonato doble de calcio y bario.
· - Ca Mg Cl O 4 = Clorato doble de magnesio y calcio.
25. COMPOSICIÓN CUANTITATIVA DE LAS SUSTANCIAS
25.1 EL MOL
Es la cantidad de sustancia que contiene unidades estructurales (átomos, moléculas u otras partículas como átomos (12 gramos de carbono es 96.023 x 1023 (número de Avogadro).
1 mol (átomos)= 6.023 x 1023 átomos
1 mol (moléculas)= 6.023 x 1023 moléculas
1 mol (iones) = 60.23 x 1023 iones
El número de Avogadro, es una constante de especies químicas como átomos, moléculas, unidades fórmula, iones o electrones. Al átomo o molécula que indica la fórmula de la sustancia se le denomina unidad fórmula.
25.2 MASA MOLAR DE LOS COMPUESTOS
La masa molar M es una propiedad física definida como la masa de una sustancia dada por cantidad de sustancia.1 Su unidad de medida en el SI es kilogramo por mol (kg/mol o kg·mol−1), sin embargo, por razones históricas, la masa molar es expresada casi siempre en gramos por mol (g/mol). . La masa molar de los compuestos, se calcula sumando las masas molares de cada uno de los átomos presentes en la fórmula; si hay más de un átomo de cualquier elemento, se debe sumar su masa tantas veces como lo indique la fórmula. Representa la masa total, es decir, el 100% del compuesto.
La masa molar de los átomos de un elemento está dado por el peso atómico de cada elemento2 multiplicado por la constante de masa molar, M
u = 1×10−3 kg/mol = 1 g/mol.3 Su valor numérico coincide con el de la masa molecular, pero expresado en gramos/mol en lugar de unidades de masa atómica (u), y se diferencia de ella en que mientras la masa molecular alude una sola molécula, la masa molar corresponde a un mol (6,022×1023) de moléculas:
M(H) = 23,557(6) u × 1 g/mol = 23,557(6) g/mol
25.3 Composición porcentual de las sustancias
Es el porcentaje de masa de cada uno de los elementos en el compuesto, siempre debe ser la misma sin importar la cantidad de la sustancia.
Calcular la composición centesimal del H2O, a partir de la fórmula: H= 1 , O = 16
H: 2 x 1 = 2 g = 2 H = ( 2/ 18) = 11.11 %
O: 1 x 16 = 16 g = 16 O= (16/18) ( 100) = 88.89 %
Masa molar H2O = 18 g
25.4 Fórmula Empírica y Molecular.
La fórmula empírica es una expresión de los átomos que forman un compuesto químico, en ella se relacionan los símbolos de los elementos con un número entero correspondiente a cada símbolo, puede coincidir o no con la fórmula molecular. Las cantidades de gramos se convierten a moles de cada elemento, recuerde que para convertir moles a gramos es necesario utilizar el peso atómico del elemento, se debe realizar una comparación entre las moles obtenidas a fin de determinar la de menor valor y deben ser divididas el cociente de esta división debe ser un numero entero, en caso contrario debe aproximarse (siempre y cuando sea posible) y se escribe la formula empírica con lo cocientes determinados para cada elemento. Ej:
La alicina es el compuesto responsable del olor característico del ajo. Un análisis de dicho compuesto muestra la siguiente composición porcentual en masa: C: 44,4%; H: 6,21%; S: 39,5%; O: 9,86%. Calcule su fórmula empírica.
Solución:
Se inicia suponiendo que hay 100 gramos de compuesto en este caso alicina, de tal manera que:
Carbono ( peso atómico = 12/mol) : 100 g x 44.4 % = 44.4 g x 1 mol = 3.7 moles de carbono
100g 12 g
Hidrógeno (peso atómico=1g/mol):100gx6.21% = 6.21gx 1 mol =6.21 moles de hidrógeno
100% 1 g
Azufre (peso atómico=32g/mol):100gx39.5%=39.5gx1mol =1.234 moles de azufre
100% 32 g
Oxígeno (peso atómico= 16g/mol):100gx9.86% =9.86gx1mol =0.61625 moles de oxígeno
100% 16g
Una vez obtenidos los moles de cada elemento se procede a realizar la división de cada uno de ellos entre las moles de menor valor que en este caso corresponden al oxígeno a fin de hallar los cocientes para escribir de la formula empírica:
C: 3,7 moles = 6,004 = 6
0,61625 moles
H: 6,21 moles = 10,07 =10
0,61625 moles
S: 1,234 moles = 2,002 =2
0,61625moles
O: 0,61625 moles = 1
0,61625moles
25.5 CALCULO DE FORMULA EMPIRICA
Para hallar la fórmula empírica de un compuesto,2 primero se obtienen los moles de cada elemento, luego se divide cada uno por el de menor valor y finalmente, por lo tanto, se hallan los números enteros más sencillos posibles.
Ejemplo:
Al realizar el análisis gravimétrico de un determinado compuesto químico se ha encontrado la siguiente composición centesimal: 69,98 % Ag; 16,22 % As; 13,80 % O. Para la determinación de la fórmula empírica o molecular del compuesto se procede de la siguiente manera:
Dividiendo el peso por el peso atómico se obtienen los moles:
- Para la plata 68,98/108= 0,65 moles
- Para el arsénico 16,22/75= 0,22 moles
- Para el oxígeno 13,80/16= 0,84 moles
Cada 0,22 moles de arsénico hay 0,65 moles de plata, para un mol de arsénico 0,65/0,22= 3 moles de plata y 0,84/0,22= 4 moles de oxígeno. La fórmula molecular es Ag3AsO4 y la masa molar y/o masa molecular del compuesto es de 463 gramos.
25.6 CALCULO DE LA FORMA MOLECULAR A PARTIR DE FORMULA EMPÍRICA
Peso Molecular de la Formula Empírica x n = (Peso Molecular de la Fórmula Molecular) Ejemplo
Determinar la formula molecular de la alicina (ejemplo 3), sabiendo que el peso molecular de su fórmula molecular es 120g/mol.
Peso molecular de la Formula empírica:
C = 12g x 3 = 36g/mol
H = 1g x 10 = 10g/mol
S = 32g x 2 = 64g/mol
O = 16g x 1 = 16g/mol
Peso Molecular = 120g/mol
N= Peso Molecular de la Fórmula empírica
Peso molecular de la Fórmula molecular
N = 120 g/mol = 1
120 g/mol
C3H10S2O x 1 = C3H10S2O
REACCIONES QUÍMICAS: TRNSFORMACIÓN DE LA MATERIA Y ENERGIA
26. ECUACIONES QUÍMICAS
Una ecuación química es una descripción simbólica de una reacción química en sus estados inicial y final y las sustancias que se obtienen (llamadas productos).
Un caso general de ecuación química sería:
![]()
A, B, C, D, representan los símbolos químicos o la fórmula molecular de los átomos o moléculas que reaccionan (lado izquierdo) y los que se producen (lado derecho).
a, b, c, d, representan los coeficientes estequiométricos, que deben ser ajustados de manera que sean reflejo de la ley de conservación de la masa.
27. LA ECUACION QUIMICA
La ecuación química ayuda a visualizar los reactivos que son los que tendrán una reacción química y el producto, que es la sustancia que se obtiene de este proceso. Además se puede ubicar los símbolos químicos de cada uno de los elementos o compuestos que estén dentro de la ecuación y poder balancearlos con mayor facilidad.
LAS REACCIONES QUIMICAS
Son mediantes símbolos, fórmulas.
Los tipos nde reacciones son:
REACCION DESCOMPOSICION.- Cuando de un solo reactante obtengo dos productos.
AB-----------------------------> A + B
REACCION DESPLAZAMIENTO.- Un elemento ocupa el lugar de otro reemplazando.
A + BC------------------> AC + B
REACCION NDOBLE SUSTITUCIÓN.- Son dos reactantes para obtener un producto las dosw Reactantes se desplaza.
AB + CD----------------> AC + BD
REACCION SINTESIS.- Es la suma de b2 reactantes para obtener un producto.
A + B------------------->AB
28. ESCRITURA Y BALANCEO DE ECUACIONES
El hidrógeno gaseoso (H2) se quema en presencia de aire (que contiene oxígeno, O2) para formar agua (H20). Esta reacción se representa mediante la ecuación química:
![]()
El signo "más" significa "reacciona con" y la flecha significa "produce". Así, esta expresión simbólica se lee:
"El hidrógeno molecular reacciona con el oxígeno molecular para producir agua."Balanceo de una ecuación química
Balancear una ecuación significa que debe de existir una equivalencia entre el número de los reactivos y el número de los productos en una ecuación. Para que un balanceo sea correcto: "La suma de la masa de las sustancias reaccionantes debe ser igual a la suma de las Masas de los productos" Existen 3 tipos de balanceo de ecuaciones químicas: Balanceo por TANTEO, OXIDO-REDUCCIÓN (REDOX) Y MATEMATICO O ALGEBRAICO:
BALANCEO POR TANTEO
Para balancear por este o todos los demás métodos es necesario conocer la Ley de la conservación de la materia, propuesta por Lavoisier en 1774, éste método es de ordenar a los elementos de la siguiente manera:
Balancear primero
Metales y/o no metales
Oxígenos
Hidrógenos
Balancear por el método de tanteo consiste en colocar números grandes denominados "Coeficientes" a la derecha del compuesto o elemento y logremos una equivalencia o igualdad entre los reactivos y los productos.
Ejemplo:
Balancear la siguiente ecuación química:
Fe2O3---------------> Fe(OH)3
Comenzaremos por el Fe (fierro) y después los O2 y finalizamos con los H2
El primer miembro se encuentra antes de la fecha denominada produce o es igual a
Y el segundo miembro se encuentra después de la fecha mencionada.
Entonces, preguntamos ¿ Cuántos Fe hay en el primer miembro? 2 , en el segundo 1 ; por lo tanto agregamos un dos grande a la izquierda del Fe
Fe2 O3 + H2O 2Fe (OH)3
Continuamos: ¿Cuántos oxígenos hay en el primer miembro? Encontramos 4 porque 3 mas 1 es igual a 4
Y ¿Cuántos en el segundo? Encontramos 6 porque el dos (situado a la izquierda del Fe) se multiplica por el subíndice encontrado a la derecha del paréntesis final y se multiplica 2*3 = 6
Por lo tanto en el segundo miembro hay 6 oxígenos.
Entonces colocamos un 3 del lado izquierdo del hidrógeno en el primer miembro para tener 6 oxígenos
![]()
Posteriormente, Vamos con los hidrógenos, en el primer miembro vemos que hay 6 hidrógenos y en el segundo igualmente 6.
Entonces concluimos de la siguiente manera:

Por lo tanto, la ecuación está balanceada.
BALANCEO POR EL MÉTODO DE ÓXIDO-REDUCCIÓN
Es también denominado "Redox" y consiste en que un elemento se oxida y (hablar de oxidación se refiere a que un elemento pierda electrones y su valencia aumente) el otro se reduce (cuando el elemento gana electrones y su valencia disminuye) para éste método se siguen los siguientes pasos o reglas:
1. Todos los elementos libres que no formen compuesto, tendrán valencia cero
2. El hidrógeno tendrá valencia de +1 excepto en hidruros con -1
3. El oxígeno tendrá valencia de 2- excepto en los peróxidos con -1
4. Los alcalinos tienen en sus compuestos oxidación +1
5. Los alcalinotérreos tienen en sus compuestos oxidación +2
6. Los alógenos tienen en sus compuestos con aluros oxidación -1
7. La suma de los números de oxidación de todos los átomos de un compuesto es igual a la carga de los compuestos
8. Si algún átomo se oxida su numero de oxidación aumenta y cuando un átomo se reduce, su número de oxidación disminuye
Ejemplo:
Balancear la siguiente ecuación:
![]()
Si vemos la primera regla, esta nos dice que todos los elementos libres tendrán valencia cero, entonces vemos la ecuación y localizamos a los elementos libres, en este caso son el fierro y el hidrógeno, colocamos un cero como valencia.
![]()
Continuamos con las demás reglas y encontramos a los oxígenos e hidrógenos y les asignamos la valencia que les corresponde, establecidas en las reglas:
![]()
Para continuar, obtenemos la valencia de los elementos que nos sobran, en este caso el azufre y el fierro:
Ubiquémonos en el azufre (S) del primer miembro en la ecuación
![]()
y posteriormente obtendremos la valencia del azufre. Quede claro que la del hidrógeno y la del oxígeno ya la tenemos.
Para obtener la valencia del azufre, simplemente vamos a multiplicar la valencia del oxígeno por el número de oxígenos que hay. (En este caso hay 4 oxígenos) y hacemos lo mismo con el hidrógeno, multiplicamos su valencia por el número de oxígenos que hay. Queda de la siguiente manera

Tenemos que llegar a cero. Buscamos cuanto falta de dos para ocho. Entonces encontramos que faltan 6, este número será colocado con signo positivo +
![]()
El 6 que acabamos de obtener es la valencia del azufre en el primer miembro.
Ubiquémonos en el fierro del segundo miembro en donde se encuentra el compuesto
![]()
Localizamos al fierro. Para obtener su valencia primero denominamos si es monovalente o divalente etc. Ya que vimos que es divalente, necesitamos saber la valencia del radical sulfato, en este caso es
![]()
Para obtener la valencia del fierro, multiplicamos la valencia del radical (-2) con el subíndice que se encuentre fuera del mismo
Después lo dividimos entre el número de fierros que hay en el compuesto (en este caso hay dos fierros)
Queda de la siguiente manera:
2 * 3 = 6 6/2 = 3
El tres que acabamos de obtener es la valencia del fierro.
Que nos quede claro, ya tenemos la valencia del fierro que es 3, ya tenemos la valencia del oxígeno que es -2, ahora nos falta la valencia del azufre (S) lo cual realizaremos algo similar con lo dicho con anterioridad:
Multiplicamos la valencia del radical sulfato (-2) con el subíndice (3) y después con el número de oxígenos que hay dentro del paréntesis (4).

Obtenemos un total de 24. Este número que resultó se le llama valencia parcial
Después continuamos con el fierro. Ahora ya que tenemos que la valencia del fierro es 3 entonces multiplicamos la valencia por el numero de fierros que hay (hay 2)
Y nos da un resultado de 6.
Entonces:
Tenemos 6 y tenemos -24, de 6 a 24 ¿Cuánto falta?
Respuesta: +18
Ahora el 18 lo dividimos entre el número de azufres que hay: nos da un total de 6 o sea +6.
Y de esta manera ya obtuvimos todas las valencias del compuesto químico:
![]()
Ahora, vamos a verificar cuál elemento se oxida y cual se reduce, para esto, chequemos las valencias de los elementos, debemos verificar que en los dos miembros estén iguales.
Si vemos al fierro en el primer miembro y luego lo vemos en el segundo. Encontramos que sus valencias ya no son las mismas por tanto el elemento se está oxidando porque aumenta su valencia de cero a 3

Ahora, si nos fijamos en el hidrógeno del primer miembro, se está reduciendo con el hidrógeno del segundo miembro:

Entonces la ecuación queda de la siguiente manera:

Ahora, para poder completar el balanceo, vamos a intercambiar los números que se oxidaron o redujeron. Esto es el 3 y el 1.
El 3 lo colocaremos en el lugar del 1 y el 1 en el lugar del 3

Estos números resultantes se colocan de lado izquierdo de los elementos que se oxidaron o redujeron.
El número 1 (que por lo general no se escribe) se coloca de lado izquierdo del fierro en los dos miembros.
El número 3 se coloca de lado izquierdo del hidrógeno en los dos miembros quedando de la siguiente forma:

Entonces de esta manera podemos deducir que la ecuación está balanceada, pero, no es así, uno de los pasos para terminarla es: "Una vez obtenidos los números de la ecuación, se completará con método de tanteo".
Verificamos si así está balanceada:
1= Fe =2
3= S =3
12= O =12
6= H =6
Con este insignificante 2 que acabos de encontrar en el fierro del segundo miembro LA ECUACIÓN NO ESTÁ BALANCEADA aunque los demás átomos lo estén.
Completamos por tanteo
En el primer miembro (Fe) hay 1 átomo, en el segundo 2, entonces colocamos un 2 en el primer miembro y…
YA ESTÁ BALANCEADA.
Con esto finalizamos el método de REDOX.
BALANCEO POR EL MÉTODO ALGEBRAICO/MATEMATICO
Se siguen los siguientes pasos:
Escribir sobre cada molécula una literal, siguiendo el orden alfabético.
Enlistar verticalmente los átomos que participan en la reacción
A la derecha del símbolo de cada elemento que participa se escribe el número de veces que el elemento se encentra en cada molécula identificada por letra.
Si de un lado de la reacción un elemento se encuentra en más de una molécula, se suman y se escribe cuantas veces está presente en una molécula
Se cambia la flecha por un signo igual =
Se enlistan las letras que representan las moléculas y a la letra más frecuente se le asigna el valor de uno
Los valores de las letras se obtienen por operaciones algebraicas
29. Tipos de reacciones químicas
Si sabemos lo que ocurre en una determinada reacción química,seremos capaces de predecir lo que ocurre en otras parecidas. Por eso es conveniente conocer los tipos más frecuentes de reacciones químicas.
Reacciones de síntesis
En este tipo de reacciones dos o más sustancias se combinan para dar un sólo producto:
N2+3H2---------> 2NH3
Reacciones de descomposición
En este caso a partir de un único compuesto se obtienen como productodos o más sustancias:
2KClO3 ---------> 2KCl + 3 O2
Reacciones de intercambio
En esta transformación un elemento se “traslada” de un compuesto aotro.
Cu + 2 AgNO3-------------> Cu(NO3)2+2Ag
30. CALOR EN LAS REACCIONES QUIMICAS
Este tipo de reacciones pertenece a un grupo más amplio de reacciones que son denominadas de oxidación. Las reacciones de combustión se caracterizan por estar acompañadas de un gran aumento de la temperatura y emisión de luz. Las combustiones más frecuentes son combinaciones con oxígeno, y los productos más habituales son el dióxido de carbono y el agua. El fuego es una manifestación de una reacción de combustión. Ya habrás aprendido que para encender el fuego es necesario que haya un elemento combustible, por ejemplo la madera y el papel, y la presencia de oxígeno. En el caso de la combustión del metano tenemos que:
CH4+2O2-------------------------------->CO2+2H2O
Si hay suficiente cantidad de oxígeno. En el caso de que la cantidad de oxígeno no sea suficiente se produce una reacción de combustión incompleta que determina la formación de otros productos:
2CH4+3O2-------------------------------> 2CO + 4 H2O
31. INTRODUCCION A LA ESTEQUIOMETRIA
La estequiometría es el cálculo de las relaciones cuantitativas entre reactivos y productos en el transcurso de una reacción química.
Es muy importante conocer exactamente las cantidades de las sustancias que estan involucradas en una reaccion. Mediante calculos estequiométricos, es posible hacer predicciones sobre la cantidad de sustancia que debe reaccionar para obtener cierta cantidad de producto. Todos estos calculos que estudian a través de la estequiometría, la palabra proviene del griego stoicheito, que significa "medir los elementos". Los calculos estequiométricos representan la única forma de determinar las cantidades de materia que participan en una reacción química.
Método de la Relación Molar
Se conocen varios métodos para resolver problemas estequiométricos, uno es el método molar o de la relación molar.
La relación molar es una relación entre la cantidad de moles de dos especies cualesquiera que intervengan en una reacción química. Por ejemplo, en la reacción
![]()
Sólo hay seis relaciones molares que se aplican. Estas son:
La relación molar es un factor de conversión cuyo fin es convertir, en una reacción química, la cantidad de moles de una sustancia a la cantidad correspondiente de moles de otra sustancia. Por ejemplo, si deseamos calcular la cantidad de moles de H2O que se pueden obtener a partir de 4.0 mol de O2, usaremos la relación molar:

https://www.guatequimica.com/tutoriales/estequiometria/Metodo_de_la_Relacion_Molar.htm
32. CALCULOS MOL - MOL
En este tipo de relación la sustancia de partida está expresada en moles, y la sustancia deseada se pide en moles.
En los cálculos estequiométricos los resultados se reportan redondeándolos a dos decimales. Igualmente, las masas atómicas de los elementos, deben utilizarse redondeadas a dos decimales.
Recordando: Para redondear con dos decimales, usamos como base el tercer decimal. Si este es mayor o igual a 5, aumentamos una unidad al segundo decimal; si es menor o igual a 4 se conservara lacifra del segundo decimal.
Ejemplos:
|
Número |
Valor redondeado a dos decimales |
|
15.28645 |
15.29 |
|
3.1247865 |
3.12 |
|
20.0054 |
20.01 |
|
155.49722 |
155.50 |
Ejemplos:
Para la siguiente ecuación balanceada::
![]()
Calcule:
a) ¿Cuántas mol de aluminio (Al) son necesarios para producir 5.27 mol de Al2O3?
PASO 1
Balancear la ecuación
Revisando la ecuación nos aseguramos de que realmente está bien balanceada. Podemos representar en la ecuación balanceada el dato y la incógnita del ejercicio.

PASO 2
Identificar la sustancia deseada y la de partida.
Sustancia deseada
El texto del ejercicio indica que debemos calcular las moles de aluminio, por lo tanto esta es la sustancia deseada. Se pone la fórmula y entre paréntesis la unidad solicitada, que en este caso son moles.
Sustancia deseada: Al (mol)
Sustancia de partida:
El dato proporcionado es 5.27 mol de óxido de aluminio (Al2O3) por lo tanto, esta es la sustancia de partida. Se anota la fórmula y entre paréntesis el dato.
Sustancia de partida: Al2O3 (5.27 mol)
PASO 3
Aplicar el factor molar
Las moles de la sustancia deseada y la de partida los obtenemos de la ecuación balanceada.


Se simplifica mol de Al2O3 y la operación que se realiza es
5.27(4)
2
Señale claramente el resultado final. La respuesta es:10.54 mol de Al
b) ¿Cuántas moles de oxígeno (O2) reaccionan con 3.97 moles de Al?
PASO 1: La ecuación está balanceada
PASO 2:
Sustancia deseada: O2 (mol)
Sustancia de partida: Al (3.97 mol)
PASO 3:
Aplicar el factor molar
Recordamos la ecuación que estamos utilizando:


Simplificamos mol de Al y resolviendo la operación
3.97(3)
4
2.9775, redondeando a dos decimales, la respuesta es 2.98 mol de O2.
33. Cálculos mol-masa
En este tipo de cálculos se involucran los gramos en la sustancia deseada o en la de partida, y la otra sustancia se expresa en moles.
34. Cálculos masa - masa
En estos ejercicios tanto la sustancia deseada como la de partida se expresan en gramos.
Ejemplos que involucran gramos:
1. Para la ecuación mostrada calcule:
a) Mol de Mg(OH)2 (hidróxido de magnesio) que se producen a partir de 125 g de agua.
b) Gramos de Mg3N2 (nitruro de magnesio) necesarios para obtener 7.11 mol deNH3 (amoniaco).

En el Mg3N2 (nitruro de magnesio) el coeficiente es 1, por lo que no debe escribirse.
a) Moles de Mg(OH)2 (hidróxido de magnesio) que se producen a partir de 125 g de agua.
PASO 1
Revisar que la ecuación esta correctamente balanceada.

PASO 2
Sustancia deseada: Mg(OH)2 (hidróxido de magnesio ) en MOL
Sustancia de partida: H2O (agua) 125 g
PASO 3
La sustancia de partida, agua, está expresada en gramos y no en moles, por lo tanto, no se puede aplicar directamente el factor molar. Es necesario realizar una conversión a moles. Para efectuarlo debemos calcular la masa molecular del agua.
Recordando: Para obtener la masa molecular, multiplicamos el número de átomos de cada elemento por su masa atómica y las sumamos.
H2O
|
H |
2 |
x |
1.01 |
=2.02 |
|
O |
1 |
x |
16 |
= 16+ |
|
|
|
|
|
18.02 g |
Para convertir a moles:

Ahora como ya tenemos el dato de la sustancia de partida en moles, podemos aplicar el factor molar. Recuerde que los datos del factor molar se obtienen de la ecuación balanceada.

PASO 4

Cancelamos moles de H2O y obtenemos moles de Mg(OH)2, que son las unidades de la sustancia deseada, y la respuesta es: 3.47 mol Mg(OH)2 .
b) Gramos de Mg3N2 (nitruro de magnesio) necesarios para obtener 7.11 moles deNH3 (amoniaco).
Como este el segundo inciso, empezamos en el paso 2.
PASO 2

Sustancia deseada: Mg3N2 (nitruro de magnesio) gramos
Sustancia de partida: NH3 (amoniaco). 7.11 mol
PASO 3
Aplicamos directamente el factor molar porque el dato de la sustancia de partida está en moles:

PASO 4
Con el factor molar calculamos la sustancia deseada en mol, pero las unidades de la sustancia deseada son gramos de Mg3N2 por lo que debemos introducir un factor de conversión de mol-gramos. Primero calculamos la masa molecular del Mg3N2.
Mg3N2
|
Mg |
3 |
x |
24.31 |
=72.93 |
|
N |
2 |
x |
14.01 |
=28.02 + |
|
|
|
|
|
100.05g |
Factor de conversión:

De esta forma obtenemos el resultado que es:356.18 g Mg3N2
35. Reactivo limitante, rendimiento y pureza
En una reacción química no necesariamente se consume la totalidad de los reactivos. Generalmente alguno de ellos se encuentra en exceso. El otro reactivo, que es el que se consume totalmente se conoce como reactivo limitante.
Para que una reacción se lleve a cabo debe haber sustancias (reactivos) capaces de reaccionar para formar los productos, pero basta que uno solo de los reactivos se agote para que la reacción termine.
En los procesos industriales generalmente se usa un exceso el reactivo mas barato y fácil de conseguir, y se selecciona como limitante el más caro o difícil de conseguir.
Ejemplo
El proceso Haber para producción de amoniaco se representa mediante la siguiente ecuación balanceada:
![]()
a) A partir de 100 g de N2 y 100 g H2. ¿cuántos g de NH3 (amoniaco) se obtienen?
b) ¿Cuál el reactivo limitante y cuál el reactivo en exceso?
c) Calcule la cantidad de g de reactivo en exceso que quedan al final de la reacción.
PASO 1
Revisar si la ecuación está balanceada.
En este caso la ecuación se muestra ya balanceada.
PASO 2
Calcular la mol de producto señalada (sustancia deseada) que se forman con cada reactivo siguiendo los pasos indicados anteriormente para la solución de los ejercicios de estequiometría.
Iniciamos el cálculo con los 100 g de N2, y podríamos representar esta parte en la ecuación, de la siguiente forma:

Sustancia deseada: NH3 g
Sustancia de partida: N2 100 g
Calculamos la masa molecular del nitrógeno para convertir a moles y poder aplicar el factor molar.
N2
2 x 14.01 = 28.02 g

Ahora realizamos el mismo procedimiento pero a partir de los 100 g de H2.

H2
2 x 1.01 = 2.02 g

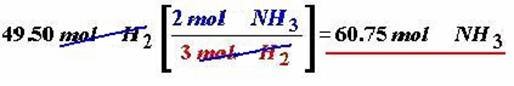
Ahora comparamos los resultados:
|
A partir de 100 g de H2: |
60.75 moles NH3 |
|
A partir de 100 g de N2: |
7.14 moles NH3 |
El reactivo limitante es el N2, porque a partir de él se obtiene el menor número de moles. Solo resta convertir esa cantidad de moles a gramos, ya que la unidad de la sustancia deseada es gramos.
NH3
|
N |
1 |
x |
14.01 |
= |
14.01 |
|
H |
3 |
x |
1.01 |
= |
3.03 + |
|
|
|
|
|
|
17.04 g |

|
Se producen 121.67 g de NH3 |
b) ¿Cuál el reactivo limitante y cuál el reactivo en exceso?
Reactivo limitante: N2
Reactivo en exceso: H2
En el momento en que el nitrógeno se consume totalmente la reacción termina, por eso la cantidad de producto depende de éste reactivo.
Para este proceso es más conveniente utilizar exceso de nitrógeno para que el reactivo limitante sea el hidrógeno, ya que el nitrógeno es un reactivo más barato y más fácil de conseguir. En el aire aproximadamente el 78.09% es nitrógeno.
c) Calcule la cantidad de gramos de reactivo en exceso que quedan al final de la reacción
Reaccionan 100 g de N2 (3.57 moles) y parte del hidrógeno queda sin reaccionar. Para encontrar los gramos de hidrógeno que no reaccionan, es necesario calcular cuántos gramos de hidrógeno que reaccionaron con 3.57 moles de nitrógeno. Conviene más utilizar el dato en moles, para poder aplicar en forma directa el factor molar y después convertimos las moles de hidrógeno obtenidas a gramos.


Utilizamos la masa moleculardel H2 calculada anteriormente: 2.02 g, para convertir moles a gramos.

Reaccionaron 21.63 g H2 y la cantidad inicial era de 100 g, por lo tanto restamos para obtener los gramos en exceso de hidrógeno.
100 g – 21.63 g = 78.37 g de hidrógeno en exceso.
La respuesta es:
|
Quedan 78.37 g de H2 en exceso |
4. Porcentaje de rendimiento.-
Cuando una reacción química se lleva a cabo, son muchos los factores que intervienen, y generalmente la cantidad de producto que se obtiene en forma real es menor que la que se calcula teóricamente. El porcentaje de rendimiento es una relación entre la producción real y la teórica expresada como porcentaje.
%Rendimiento = producción real
producción teorica
El porcentaje de rendimiento depende de cada reacción en particular. Hay reacciones con un alto % de rendimiento y otras donde el rendimiento es relativamente pobre.
Ejemplo
En base a la siguiente ecuación balanceada:
![]()
a) ¿Cuántos gramos de NaCl (cloruro de sodio) se obtienen sí reaccionan 20.0 g de NaHCO3 (bicarbonato de sodio) con 17.6 g de HCl (ácido clorhídrico)?
b) ¿Cuál es el porcentaje de rendimiento de la reacción si se obtuvieron realmente 13.9 g de NaCl?

Primero calculamos la producción de cloruro de sodio a partir de 20.0 g del NaHCO3 (bicarbonato de sodio).
NaHCO3
|
Na |
1 |
x |
22.99 |
= |
14.01 |
|
H |
1 |
x |
1.01 |
= |
1.01 |
|
C |
1 |
x |
12.01 |
= |
12.01 |
|
O |
3 |
x |
16.00 |
= |
48.00 + |
|
|
|
|
|
|
75.03 g |


Ahora calculamos las moles de cloruro de sodio a partir de 17.6 g de HCl.
|
H |
1 |
x |
1.01 |
= |
1.01 |
|
Cl |
1 |
x |
35.45 |
= |
35.45 + |
|
|
|
|
|
= |
36.46 g |


Comparamos nuestros resultados:
|
A partir de NaHCO3 |
0.27 mol de NaCl |
|
A partir del HCl |
0.48 mol de NaCl |
El reactivo limitante es el NaHCO3 (bicarbonato de sodio), ya que con este reactivo se obtienen menos moles de NaCl (cloruro de sodio). Solo resta convertir estas moles a gramos.
NaCl
|
Na |
1 |
x |
22.99 |
= |
22.99 |
|
Cl |
1 |
x |
35.45 |
= |
35.45 + |
|
|
|
|
|
= |
58.44 g |
![]()

Se producen 15.78 g de NaCl
b) ¿Cuál es el porcentaje de rendimiento de la reacción si se obtuvieron realmente 13.9 g de NaCl?
Aplicando la fórmula del porcentaje de rendimiento:

36. CALCULOS DE ENTALPIA DE REACCION
esulta extremadamente importante saber la cantidad de calor que interviene al producirse una reacción química. En algunos casos, es necesario comunicar energía en forma de calor para que la reacción se produzca (proceso endotérmico), y eso supone un coste económico para suministrar esa energía al sistema. En otros, se desprende energía al transformase los reactivos en productos (proceso exotérmico) y ahora el coste es de instalación, porque hay que refrigerar el reactor, que debe soportar temperaturas altas, aunque el calor desprendido se puede aprovechar (por ejemplo, para calefacción).
Los combustibles tiene diferente capacidad para producir calor en función de cuánto calor desprenden al quemarse, por lo que se necesita saber su entalpía de combustión. ¿Qué sustancia proporciona más calor al quemarse, el propano o el butano, que son dos de los gases más utilizados? ¿Y qué tal resultado dan la madera o el carbón?
Además, resultaría muy interesante poder saber esos valores sin tener que medirlos experimentalmente, utilizando datos de otras reacciones o consultando tablas de datos. Con ese fin se utilizan tres métodos, que vas a ver a continuación:
1. Por aplicación de la ley de Hess.
2. Utilizando las entalpías de formación.
3. A partir de las energías de enlace.
LEY DE HESS
En 1840, Hess demostró experimentalmente que la cantidad de calor puesta en juego en un reacción a presión o volumen constante no depende del camino seguido y es independiente de que el proceso transcurra en una o más etapas (ley de Hess).
A esta misma conclusión ya hemos llegado anteriormente mediante la termodinámica (ΔU = Qv ; ΔH = Qp), ya que si ambos calores son funciones de estado, no dependen del camino seguido en la transformación. Por lo tanto, la ley de Hess no debería considerarse como una ley independiente, pero sucede que la Termoquímica es históricamente anterior a la Termodinámica, y cuando ésta estableció sus principios, aquélla ya había enunciado sus leyes y tenía sus propios convenios.
Fíjate en la imagen. La reacción de la que queremos saber su ΔH es A → D. Pero esa reacción se puede producir de forma directa (A produce D) o en tres fases:
Reacción 1: A → B; ΔH1
Reacción 2: B → C; ΔH2
Reacción 3: C → D; ΔH3
La reacción directa es la resultante de estas tres: A se transforma en B, pero B lo hace en C y C en D, con lo que, globalmente, A se transforma en D. Este razonamiento se puede expresar matemáticamente diciendo que la reacción global es la suma de las tres reacciones: si escribes como reactivos totales todos los reactivos de las tres reacciones y haces lo mismo con los productos, obtienes
A + B + C → B + C +D
Que, eliminando B y C que aparecen tanto en reactivos como en productos, se transforma en A → D.
En general, la reacción global no se obtiene como suma de las reacciones, sino que hay que multiplicarlas por un número (si intervienen dos moles de una sustancia, pero en una reacción solamente aparece uno, habrá que multiplicar esa reacción por dos) o incluso darle la vuelta, transformando los reactivos en productos y los productos en reactivos (multiplicando por -1).
ENTALPIA ESTANDAR DE FORMACION
Como has visto, es posible determinar la variación de entalpía de cualquier proceso si se conocen los contenidos energéticos de los estados inicial y final. Ahora bien, esos estados energéticos dependen de las condiciones de presión, temperatura y estado de agregación. Para poder comparar valores, hay que medirlos en las mismas condiciones: las medidas se realizan siempre en condiciones estándar, que son 0 ºC y 1 atm. Se indica con un superíndice º a la derecha de la magnitud, pero a veces no se explicita porque se supone que siempre se trabaja en esas condiciones.
Ahora vas a analizar una reacción muy sencilla y conocida, la combustión del carbón:
C(s) + O2(g) → CO2(g)
La variación de entalpía producida en esta reacción será:
ΔHf[CO2(g)] = H[CO2(g)] - H[C(s)] - H[O2(g)]
El problema existente es que no se puede saber el contenido energético absoluto de las sustancias: ¿cuánta energía tiene un mol de carbón?
Por tanto, parece que no será posible determinar entalpías de reacción. Pero como lo importante no es la energía que contiene una sustancia sino la variación que experimenta su energía en las reacciones, el problema se puede resolver.
Para ello, hay que asignar un cero arbitrario de energía química, igual que se hace en el caso de la energía potencial: la diferencia de energía entre dos situaciones es la misma, independientemente de cuáles sean sus valores por el hecho de cambiar el nivel cero (si haces ascender un objeto h metros, su energía potencial aumenta en mgh julios, y da igual dónde esté el cero de energía potencial y, por tanto, el valor de la energia potencial antes y después de subirlo).
En el caso de las reacciones químicas se toma como nivel cero de energía el que tienen las sustancias simples en el estado que presentan en condiciones estándar. Por tanto, en el caso de la combustión del carbón, tanto H[C(s)] como H[O2(g) son cero, con lo que se obtiene que:
ΔHf[CO2(g)] = H[CO2(g)]
Es decir, se identifica la entalpía de una sustancia (valor que no se puede medir) con su entalpía de formación (que se determina experimentalmente sin dificultades).
Por ejemplo, ΔHf[CO2(g)] = -393,5 kJ/mol. Fíjate en que ese valor no quiere decir que el CO2 tenga energía negativa (¡es una barbaridad hablar de energía negativa!), sino que la entalpía de un mol de CO2(g) es menor en 393,5 kJ que la suma de la de un mol de C(s) y de un mol de O2(g).
A PARTIR DE LAS ENTALPIAS DE FORMACION
¿Cómo puedes calcular entalpías de reacción utilizando datos de entalpías de formación? No tienes más que escribir la reacción, ajustarla, buscar los datos que necesites en la tabla de datos (que conviene que imprimas) y utilizar la expresión siguiente:
ΔHºr = Σ nP ΔHºf(P) - Σ nR ΔHºf(R)
Es decir, sumar el contenido energético de los productos y quitarle la suma del contenido energético de los reactivos, teniendo en cuenta la cantidad de sustancia que interviene de cada una de las sustancias.
El simulador que tienes a continuación vas a utilizarlo para trabajar con entalpías, H. En el tema siguiente utilizarás las otras dos magnitudes, entropía S y energía libre G, que también aparecen en la tabla de datos.
Tienes cuatro ejemplos de cálculo resueltos (pulsa calcular para ver cómo se resuelven), pero puedes resolver otros muchos: solamente tienes que seleccionar el tipo de reacción y la sustancia, buscando los datos en la tabla de valores del propio simulador.
UTILIZANDO LAS ENTALPIAS DE ENLACE
Se llama energía de enlace a la cantidad de energía necesaria para romper un enlace en un mol de sustancia. Se suele utlizar el término entalpía de enlace, ya que las reacciones se producen habitualmente a presión constante. Las sustancias deben estar en estado gaseoso, para que la energía comunicada se invierta en romper enlaces y no en cambios de estado.
|
|
|
|
Imagen 15 Elaboración propia |
Imagen 16 Elaboración propia |
Fíjate en la imagen de la izquierda: la energía química de los átomos A y B unidos es menor que cuando están separados. La energía de enlace es precisamente la disminución de energía observada, pues será el valor que habrá que comunicar para que se separen cuando están unidos.
Se trata de valores promedio, ya que la energía de un enlace C-C no es la misma en el etano que en el butano, ya que en un caso solamente hay hidrógenos unidos a los átomos de carbono enlazados y en el otro hay grupos más complejos (metilo, etilo, etc). En las tablas de datos se indica la media de los valores medidos experimentalmente. Por esa razón, a veces hay diferencias apreciables entre los resultados obtenidos utilizando entalpías de formación y los obtenidos con energías de enlace, que son aproximados. Estas diferencias son más notables cuanto más compleja es la reacción.
Una vez tabuladas, las energías de enlace se utilizan para calcular entalpías de reacción. Para ello, es necesario detallar qué enlaces se rompen y se forman en la reacción, sumando las energía de enlace de los enlaces rotos y restando las de los enlaces formados. Previamente, es necesario detallar el mecanismo de reacción, es decir, los enlaces que se deben romper para que los reactivos se puedan transformar en productos, así como los enlaces formados en los productos.
ΔH = ∑ nR E (enlaces rotos) - ∑ nP E (enlaces formados)
donde nR y nP son el número de enlaces de cada tipo rotos o formados en el proceso.
Utiliza el simulador para determinar entalpías de reacción utilizando energía de enlace. Selecciona la reacción, detalla su mecanismo, busca los datos que necesites en la tabla de valores y determina el valor resultante.
https://e-ducativa.catedu.es/44700165/aula/archivos/repositorio//4750/4847/html/2_clculo_de_entalpas_de_reaccin.html